
【题目】某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。根据图像判断错误的是( )

A. a值一定大于9
B. Ⅰ为NaOH溶液稀释时溶液的pH变化曲线
C. 完全中和稀释相同倍数后的两溶液,消耗相同浓度的稀H2SO4的体积V(NaOH)<V(氨水)
D. 稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
【答案】D
【解析】
氢氧化钠溶液和氨水具有相同的体积和pH,由于氢氧化钠是强电解质,则氢氧化钠的浓度小,氨水浓度大,在稀释时促进氨水的电离,则氨水中的离子浓度大,即I是氢氧化钠的pH变化曲线,Ⅱ是氨水的pH变化曲线,据此分析解答。
A.pH=11的氢氧化钠溶液加水稀释100倍,pH=9,而一水合氨为弱电解质,加水促进电离,则a的数值一定大于9,故A正确;
B.一水合氨为弱电解质,由图可知,开始的pH相同,在稀释时,促进氨水的电离,则氨水中的离子浓度大,可知I为氢氧化钠溶液稀释时溶液的pH变化曲线,Ⅱ是氨水的pH变化曲线,故B正确;
C.由于氨水浓度较大,则完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水),故C正确;
D.稀释后氨水中氢氧根离子浓度较大,则水的电离程度较小,故D错误;
故选D。


科目:高中化学 来源: 题型:
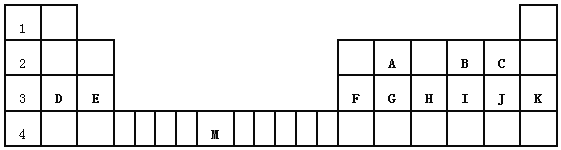
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是__________。
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是__________。
(3)10种元素中最高价氧化物的水化物,酸性最强的是__________。
(4)元素⑦组成的含非极性键的分子的电子式:__________。
(5)区分①、②的碳酸正盐的简单实验方法__________。
(6)①和⑤最高价氧化物对应的水化物相互反应的离子方程式为__________。
(7)③的单质与⑥的最高价氧化物反应的方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验。 请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是________ (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取一定量的草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,表格中记录了实验数据:
滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
①滴定时发生的离子反应方程式___________,KMnO4溶液应装在______________ (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是_________________________________。
②该草酸溶液的物质的量浓度为_____________。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是______(填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)元素B的单质含有的化学键为_____。(填“离子键’’、“极性共价键”、“非极性共价键”)
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
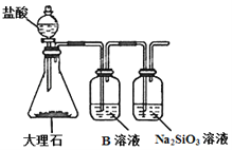
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇和浓硫酸反应制备乙烯,化学方程式为:C2H5OH![]() CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷
CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷
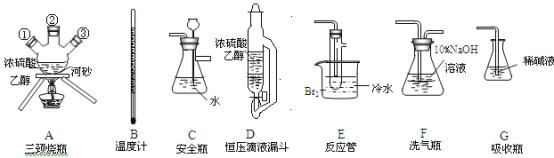
(1)如果气体流向从左到右,正确的连接顺序是:
B经A①插入A中,D接入②;A③接__接__接___接___。
(2)温度计水银球的正确位置是_________。
(3)装置D与分流漏斗相比,其主要优点是_______。
(4)装置C的主要作用是_______,装置F的作用是__________。
(5)在反应管E中进行的主要反应的化学方程式为________。
(6)装置E烧杯中的泠水和反应管内液溴上的水层作用均是_______________。若将装置F拆除,在E中的主要反应为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从含有CuCl2、FeCl2、FeCl3的工业废液中回收铜并制备氯化铁晶体的流程如下:
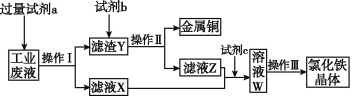
则下列说法正确的是
A. 试剂a是铁,试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用的仪器完全相同
C. 试剂c是氯气,反应的离子方程式为2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
D. 用KSCN溶液可检验溶液W中是否有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组拟配制0.10 mol·L-1的氢氧化钠溶液并进行有关性质实验,回答下列问题。
(1)若实验中大约要使用475 mL 氢氧化钠溶液,至少需要称量氢氧化钠固体________g。
(2)从如图中选择称量氢氧化钠固体所需要的仪器________(填序号)。

(3)定容时加水超过刻度线,会使配制溶液的浓度_________(偏高,偏低或不变)。
(4)下列情况会使所配溶液浓度偏低________(填序号)。
①称量读数时,左盘高,右盘低
②溶液转移到容量瓶后,未进行洗涤操作
③转移溶液前容量瓶内有少量蒸馏水
④定容时,仰视容量瓶的刻度线
⑤在烧杯中溶解氢氧化钠后,立即将所得溶液注入容量瓶中
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )
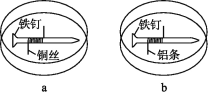
A. a中铁钉发生反应:Fe-3e-=Fe3+
B. b中铁钉上发生还原反应
C. a中铜丝上发生氧化反应:O2+2H2O+4e-=4OH-
D. b中铝条附近有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。下列判断不正确的是( )

A. 原上层液体可能是KI的水溶液,原下层液体可能是CCl4
B. 搅拌后两层液体颜色发生变化的原因是I2在CCl4中的溶解度大于在水中溶解度,所以绝大部分I2都转移到CCl4中
C. 阴极区域pH增大的原因是水分子得电子生成了OH—
D. 阳极上的电极反应式2H++2e - =H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com