
【题目】根据如图的能量图,下列说法正确的是
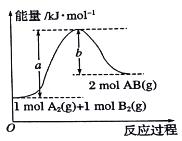
A. A2(g)+B2(g)=2AB(g)是一个放热反应
B. 2molAB的总能量大于1molA2和lmolB2的能量之和
C. 1molA2(g)和1molB2(g)的能量之和为akJ
D. 2AB(g)=A2(l)+B2(l)△H<(b-a)kJ/mo1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子晶体中一定存在共价键和范德华力
B.由非金属元素组成的化合物一定是共价化合物
C.原子晶体和分子晶体一定均含有共价键,离子晶体也可能含有共价键
D.两个非金属元素原子间不可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:

(1)3种试剂的化学式:A______,B______,C______。
(2)加过量A的原因是___________________________________________________________,有关反应的化学方程式为________________________________________________________________。
(3)加过量B的原因是______________________________________________________,有关反应的化学方程式为_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将nmol/L氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )

A. a点Kw=1.0×10-14
B. 水的电离程度:b>c>a>d
C. b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D. 25℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中不正确的是()
A. 若由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2NA
B. 压强为1.01×105Pa时,48g O2和O3的混合物中含有的原子数为3NA
C. 常温下,8 g NH4NO3所含的氮原子数为0.1NA
D. 1.7 g H2O2中含有的电子数为0.9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是
A. 1mol—CH3中含有的质子数为10NA
B. H2O2+Cl2=2HC1+O2反应中,每生成32g O2转移2NA个电子
C. 3.6gCO和 CO2的混合气体含中子数为1.8NA
D. 6.2g 白磷含有0.3NAP-P键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是硫酸试剂瓶标签上的内容:

(1)该硫酸的物质的量浓度是________mol/L
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要 240mL4.6mol/L 的稀硫酸,用该硫酸配制,选取的容量瓶规格为 250mL,则需要量取________mL 的该硫酸.
(3)用上述硫酸配制所需的稀硫酸时,实验仪器有:
①50mL 量筒 ②100mL 量筒 ③托盘天平 ④玻璃棒 ⑤250mL 容量瓶 ⑥胶头滴管 ⑦烧杯 ⑧锥形瓶
实验时选用仪器的先后顺序为 → →④→ → ._____________
(4)下列情况导致所配硫酸溶液物质的量浓度偏高的有________.
①未经冷却趁热将溶液注入容量瓶中
②容量瓶用 4mol/L 硫酸润洗
③定容时仰视观察液面
④颠倒摇匀后发现液面低于刻度线再加水
⑤用量筒量取浓硫酸后,用蒸馏水洗涤量筒,洗液也转移至容量瓶中.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某非金属元素R的最高价氧化物的水化物是HnRO2n-2,则在气态氢化物中R元素的化合价是:( )
A.3n-10B.12-3nC.3n-4D.3n-12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com