
| A. | H2与D2 | B. | T2O与H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 金刚石与石墨 |
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:填空题

 .
. ,化合物Ⅳ通过消去反应生成化合物Ⅰ的化学方程式为
,化合物Ⅳ通过消去反应生成化合物Ⅰ的化学方程式为 .
.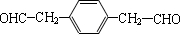 (写一种即可).
(写一种即可). 单体的结构简式为
单体的结构简式为 ;利用题中所给信息,自选合适的原料通过一步反应合成该单体,写出其化学方程式
;利用题中所给信息,自选合适的原料通过一步反应合成该单体,写出其化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
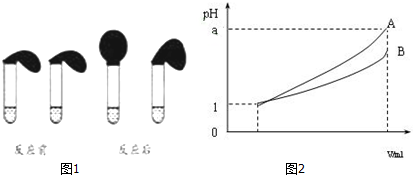
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
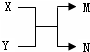
| A. | 若X为Fe,N为氢气,则Y一定为酸 | |
| B. | 若X、N为化合物,Y为水,则M一定是气体单质 | |
| C. | 若X、Y、M、N均为化合物,该反应一定属于复分解反应 | |
| D. | 若X、Y、M、N均为10电子微粒,且M是工业生产HNO3的一种原料气,则N常温下一定呈液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
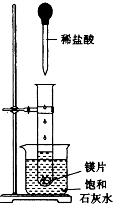 如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:
如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
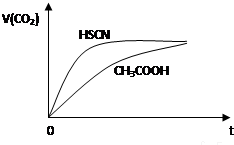
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中:K+、C6H5OH、Br-、NO3- | |
| B. | 在氨水溶液中 Al3+、NO3-、Cl-、Ag+ | |
| C. | 某透明澄清的溶液中:NH4+、Fe3+、NO3-、Cl- | |
| D. | 能使甲基橙显红色的溶液:K+、Cr2O72-、CH3CH2OH、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn 2++Cu | |
| B. | 氢氧化钠溶液与盐酸反应:OH-+H+═H2O | |
| C. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com