
【题目】某小型化工厂生产皓矾(ZnSO4·7H2O)的工艺流程如下图所示:

已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为Fe(OH)3:2.7~3.7;Fe(OH)2:7.6~9.6;Zn(OH)2:5.7~8.0。
试回答下列问题:
(1)加入的试剂①应是________,其目的是____________________________________。
(2)加入的试剂②,供选择使用的有:氨水、NaClO溶液、20% H2O2溶液、浓硫酸、浓硝酸等,应选用________,其理由是_____________________。
(3)加入的试剂③是________,目的是______________________________________。
【答案】Zn 将Cu2+、Fe3+、Fe2+等杂质离子除去 20% H2O2溶液 H2O2作氧化剂,可将Fe2+氧化为Fe3+,且不引入其他杂质 ZnO或Zn(OH)2(答案合理即可) 调节溶液的pH,使Fe3+转化为Fe(OH)3沉淀
【解析】
此小型化工厂的生产目的,是制取皓矾(ZnSO4·7H2O),所以流程的主线是有关ZnSO4的除杂与净化。溶液A中肯定含有大量ZnSO4,则滤液D中含有ZnSO4,沉淀A必然是金属单质。
(1)由以上分析,可确定加入的试剂①应是能将Cu2+、Fe2+、Fe3+转化为金属单质的某金属,从而去除杂质。
(2)选择试剂②时,应从能将Fe2+氧化为Fe3+,且不引入新的杂质离子的角度考虑。
(3)加入的试剂③是能将Fe3+全部转化为Fe(OH)3沉淀,且不引入新的杂质的物质。
(1)由以上分析,可确定加入的试剂①应是金属活动性比Fe、Cu强的Zn,能将Cu2+、Fe2+、Fe3+转化为金属单质,且过量时可再利用。答案为:Zn;将Cu2+、Fe3+、Fe2+等杂质离子除去;
(2)试剂②,能将Fe2+氧化为Fe3+,所以该物质应具有较强的氧化性,可选择NaClO溶液、20% H2O2溶液、浓硫酸、浓硝酸等,但NaClO溶液、浓硫酸、浓硝酸都会引入新的杂质,所以只能选择20% H2O2溶液。答案为:20% H2O2溶液;
(3)加入的试剂③,能将Fe3+全部转化为Fe(OH)3沉淀,即具有消耗H+、促进Fe3+水解的能力,且不引入新的杂质,由此确定该物质为锌的氧化物、氢氧化物、碳酸盐等,但不能是金属锌(会将Fe3+还原)。答案为:ZnO或Zn(OH)2(答案合理即可);调节溶液的pH,使Fe3+转化为Fe(OH)3沉淀。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列物质中:①甲苯②聚异戊二烯③汽油④![]() ⑤聚乙烯⑥
⑤聚乙烯⑥![]() ,⑦丁子香酚
,⑦丁子香酚 ,根据题意,填写序号.
,根据题意,填写序号.
(1)既能使溴水褪色,也能使酸性高锰酸钾褪色的烃是__.
(2)能和碳酸氢钠反应的是__,写出它与碳酸氢钠反应的方程式__.
(3)写出⑥与足量氢氧化钠溶液共热反应的方程式__.
(4)丁子香酚不具有的性质是__(填序号);
A.易溶于水 B.通常状况下呈固态
C.可发生消去反应 D.遇FeCl3溶液显紫色.
(5)丁子香酚有多种同分异构体,写出符合下列要求的两个同分异构体的结构简式:__等.
①苯环上的一氯取代物为两种; ②遇FeCl3溶液显色; ③能发生银镜反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电气石是一种具有保健作用的天然石材,其中含有的主要元素为B、Si、Al、Mg、Na、O等元素。
(1)上述元素中,原子半径最小的是_________(用元素符号表示),在元素周期表中处于金属和非金属分界线附近的元素是_____________(用元素符号表示);
(2)表示原子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式,从中选择最详尽描述核外电子运动状态的方式,来表示氧元素原子核外电子的运动状态______________;
(3)B与最活泼的非金属元素F形成化合物BF3,检测发现BF3分子中三根B—F键的键长相等,三根键的键角相等,能否仅仅依据此数据此判断BF3分子的极性____________;
(4)SiO2晶体的熔点比BF3晶体________(选填“高”、“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I的形式存在,几种粒子之间的转化关系如图所示。已知淀粉遇单质碘变蓝,下列说法中正确的是

A. 向含I的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝
B. 途径II中若生成1 mol I2,消耗1 mol NaHSO3
C. 氧化性的强弱顺序为Cl2>I2>IO3
D. 一定条件下,I与IO3可能生成I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放,脱硝的方法有多种。
完成下列填空:
Ⅰ直接脱硝
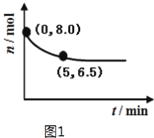
(1)NO在催化剂作用下分解为氮气和氧气。在10L密闭容器中,NO经直接脱硝反应时,其物质的量变化如图1所示。则0~5min内氧气的平均反应速率为___mol/(Lmin)。
Ⅱ臭氧脱硝
(2)O3氧化NO结合水洗可完全转化为HNO3,此时O3与NO的物质的量之比为___。
Ⅲ氨气脱硝
(3)实验室制取纯净的氨气,除了氯化铵外,还需要___、___(填写试剂名称)。不使用碳酸铵的原因是___(用化学方程式表示)。
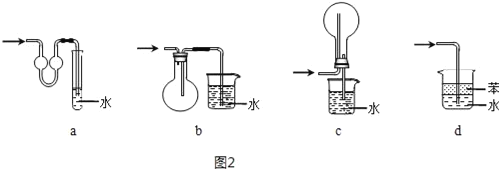
(4)吸收氨气时,常使用防倒吸装置,图2装置不能达到此目的是___。
NH3脱除烟气中NO的原理如图3:
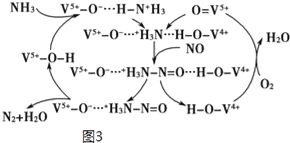
(5)该脱硝原理中,NO最终转化为___(填化学式)和H2O。当消耗1molNH3和0.25molO2时,除去的NO在标准状况下的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.活泼非金属单质在氧化还原反应中只作氧化剂
C.阳离子只有氧化性,阴离子只有还原性
D.含有某元素最高价态的化合物不一定具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
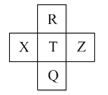
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:R>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下有可逆反应:A(g)+2B(g)![]() 2C(g)+D(g)。现将5mol A和10mol B加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示.下列有关说法正确的是
2C(g)+D(g)。现将5mol A和10mol B加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示.下列有关说法正确的是
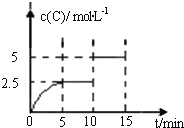
A.在0~5min内,正反应速率逐渐增大
B.反应从起始至5min时,B的转化率为50%
C.5min时的平衡常数与10min时的平衡常数不等
D.第15min时,B的体积分数为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等。过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量。某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量。

【1】实验前需进行的操作是: _______,稀盐酸中加入少量FeCl3溶液的作用是:_________。
【2】用恒压分液漏斗的优点有:
① ___________;
② 使分液漏斗内液体顺利滴下。
实验结束时,待恢复至室温,先_______,再平视刻度线读数。
实验室还可通过下列两种方案来测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
【3】推算该样品中过氧化镁的质量分数_______ (用含a、b的表达式表示)。
方案Ⅱ:称取0.1 g样品置于某定量用锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗28.5 mL Na2S2O3溶液。(已知:I2+2Na2S2O3→Na2S4O6+2NaI)
【4】该实验在滴定前需加入少量______作指示剂;判断到达滴定终点的现象是_____;推算该样品中过氧化镁的质量分数为____(保留三位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com