
| ʱ��/min | C��H2��/mol��L-1 |
| 0.40 | |
| 2 | 0.28 |
| 4 | 0.19 |
| 6 | 0.13 |
| 8 | 0.08 |
| 10 | 0.04 |
| 12 | 0.04 |
 ������� ������ĸ����
������� ������ĸ����
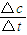 ����v��H2��������������֮�ȵ��ڻ�ѧ������֮�ȼ���v��CH3OH����
����v��H2��������������֮�ȵ��ڻ�ѧ������֮�ȼ���v��CH3OH����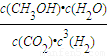 ����������ʽ�������ֵ�Ũ�ȱ仯����ƽ��ʱ����ֵ�Ũ�ȣ�����ƽ�ⳣ�����㣻
����������ʽ�������ֵ�Ũ�ȱ仯����ƽ��ʱ����ֵ�Ũ�ȣ�����ƽ�ⳣ�����㣻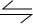 CH3OH+H2O��
CH3OH+H2O��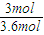 ×58.8kJ=49kJ��������������Ӧ��CO2+3H2
×58.8kJ=49kJ��������������Ӧ��CO2+3H2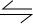 CH3OH+H2O�ķ�Ӧ�ȡ�H=-49kJ/mol��
CH3OH+H2O�ķ�Ӧ�ȡ�H=-49kJ/mol��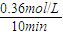 =0.036mol/��L?min����
=0.036mol/��L?min���� v��H2��=
v��H2��= ×0.036mol/��L?min��=0.012mol/��L?min����
×0.036mol/��L?min��=0.012mol/��L?min���� CH3OH+H2O��-49kJ/mol��0.012mol/��L?min����
CH3OH+H2O��-49kJ/mol��0.012mol/��L?min����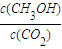 ������A����
��С����A����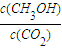 ���䣬��B����
���䣬��B����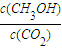 ����C��ȷ��
����C��ȷ��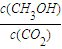 ����D��ȷ��
����D��ȷ��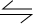 CH3OH��g��+H2O��g��
CH3OH��g��+H2O��g��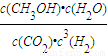 =
=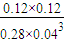 =803.6��
=803.6�� CH3OH��g��+H2O��g����֪����ͬʱ����H2��Ũ�ȱ仯��CO2Ũ�ȱ仯��3�����ٸ��ݱ���������ʱ�̵�Ũ�ȣ����������̼�ĸ�ʱ��Ũ�ȣ�
CH3OH��g��+H2O��g����֪����ͬʱ����H2��Ũ�ȱ仯��CO2Ũ�ȱ仯��3�����ٸ��ݱ���������ʱ�̵�Ũ�ȣ����������̼�ĸ�ʱ��Ũ�ȣ�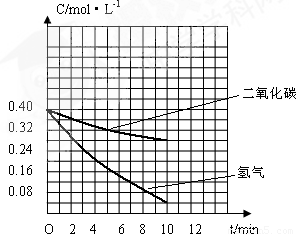 ���ʴ�Ϊ��
���ʴ�Ϊ��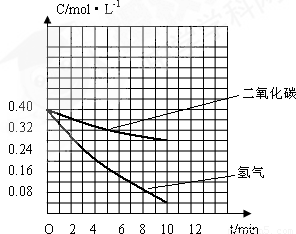 ��
��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �籾����������δ�ܾͼ�����������Լ������Э�飬����������CO2�������Ӱ�����˹�ʶ�����ڻ����о�����ѭ������CO2��CO2��g����H2��g����Ӧ������CH3OH��g����H2O��g����ijʵ��С��Ϊ�о��÷�Ӧ����������ʵ�飮��ij�¶��£����ݻ�Ϊ10L�ĺ��º��������г���a mol CO2��a mol H2����ò�ͬʱ�̵�c��H2�����ұ���
�籾����������δ�ܾͼ�����������Լ������Э�飬����������CO2�������Ӱ�����˹�ʶ�����ڻ����о�����ѭ������CO2��CO2��g����H2��g����Ӧ������CH3OH��g����H2O��g����ijʵ��С��Ϊ�о��÷�Ӧ����������ʵ�飮��ij�¶��£����ݻ�Ϊ10L�ĺ��º��������г���a mol CO2��a mol H2����ò�ͬʱ�̵�c��H2�����ұ���| ʱ��/min | C��H2��/mol��L-1 |
| 0 | 0.40 |
| 2 | 0.28 |
| 4 | 0.19 |
| 6 | 0.13 |
| 8 | 0.08 |
| 10 | 0.04 |
| 12 | 0.04 |
 CH3OH+H2O
CH3OH+H2O CH3OH+H2O
CH3OH+H2O| c(CH3OH) |
| c(CO2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ʱ��/min | C��H2��/mol��L-1 |
| 0 | 0.40 |
| 2 | 0.28 |
| 4 | 0.19 |
| 6 | 0.13 |
| 8 | 0.08 |
| 10 | 0.04 |
| 12 | 0.04 |
| c(CH3OH) |
| c(CO2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��0118 ģ���� ���ͣ������


�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com