
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.含有0.1NA个CO32﹣的Na2CO3固体的质量为10.6g
C.标准状况下,aL的氧气和氮气的混合物含有的原子数为 ![]() ×NA
×NA
D.标准状况下,11.2LCCl4含有的分子数为0.5NA
科目:高中化学 来源: 题型:
【题目】钡与钠相似,也能形成含O22﹣的过氧化物,下列叙述中正确的是( )
A.过氧化钡的化学式为Ba2O2
B.O22﹣的电子式为: ![]()
C.反应Na2O2+2HCl═2NaCl+H2O2为氧化还原反应
D.过氧化钡和过氧化钠都具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,完成题目:
(1)质量之比为7:6的两种气体CO和NO,分子数之比为;氧原子数之比为;相同条件下的体积之比为 .
(2)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mgmol﹣1 . 若阿伏加德罗常数用NA表示,则:①该气体的物质的量为mol.
②该气体所含原子总数为个.
③该气体在标准状况下的体积为L.
④该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 .
⑤该气体溶于水后形成VL溶液,其溶液的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分,其中的编号代表所对应的元素.请回答下列问题: 
(1)⑧号元素的基态原子的价电子排布式是 , 与其同周期,且基态原子的核外未成对电子数最多的元素是(写出元素符号).
(2)④号与⑦号元素形成的氧化物的熔点由高到低的是 .
(3)①号与③号元素形成的含有18电子的分子为(写出名称),该分子中③号元素的原子的杂化方式为 . ②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为(用对应的元素符号表示). 
(4)下表是某些短周期元素的电负性值:
元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
电负性 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.1 |
①通过分析电负性值变化规律,确定N最接近的电负性值范围:<N< .
②推测电负性值与原子半径关系是 .
③试推断:AlBr3中化学键类型是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100molL﹣1 NaOH溶液分别滴定20.00mL 0.100molL﹣1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( ) 
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C.V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣)
D.V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题: 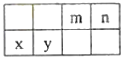
(1)元素x在周期表中的位置是第周期,第族,其单质可采用电解熔融的方法制备.
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是 , 碱性最强的是 . (填化学式)
(3)气体分子(mn)2的电子式为 . (mn)2成为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯甲酸乙酯在OH﹣存在下发生水解反应: O2NC6H4COOC2H5+OH﹣O2NC6H4COO﹣+C2H5OH
两种反应物的初始浓度均为0.050molL﹣1 , 15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示.回答下列问题:
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
(1)列示计算该反应在120~180s与180~240s区间的平均反应速率、;比较两者大小可得出的结论是 .
(2)列式计算15℃时该反应的平衡常数 .
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可采取的措施有(要求写出两条).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25度时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL盐酸,试回答下列问题. 
(1)实验中观察到的现象是 .
(2)产生上述现象的原因是 .
(3)由此推知,MgCl2溶液和H2的总能量(填“大于”、“小于”或“等于”)镁片和盐酸的总能量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁是科学家们制备的一种重要化合物,它可由单只直接化合而成,它与水作用的产物之一为NH3 . 请回答下列问题:
(1)Na3N是由键形成的化合物,写出它的电子式: .
(2)Na3N与水反应属于(填基本反应类型),写出该反应的化学方程式: .
(3)Na+与N3﹣的半径关系是Na+(填“>”、“<”或“=”)N3﹣ .
(4)Mg3N2与盐酸的反应生成种盐,用电子式表示其中只含有离子键的盐的形成过程 , 写出另一种盐的电子式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com