
分析 反应中KClO3中的+5价的氯化合价降为ClO2中+4价的氯,HCl中-1价的氯化合价升高为Cl2中0价的氯,生成1molClO2,得到2mol电子,生成1molCl2,失去2mol电子守恒,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
依据方程式结合氧化还原反应中所含元素化合价降低的被还原,所含元素化合价升高的被氧化解答.
解答 解:反应中KClO3中的+5价的氯化合价降为ClO2中+4价的氯,HCl中-1价的氯化合价升高为Cl2中0价的氯,生成1molClO2,得到2mol电子,生成1molCl2,失去2mol电子守恒,依据氧化还原反应得失电子守恒可知:ClO2系数为2,Cl2系数为1,则KClO3系数为2,依据原子个数守恒可知:KCl系数为2,HCl系数为4,H2O系数为2,方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+1Cl2↑+2H2O;
依据方程式:2KClO3+4HCl(浓)=2KCl+2ClO2↑+1Cl2↑+2H2O,反应中2molKClO3中+5价的氯化合价降低,则被还原的氯原子为2mol;反应中4molHCl只有2mol-1价的氯化合价升高被氧化,所以被氧化的氯原子为2mol,则被氧化的氯元素与被还原的氯元素的质量之比是1:1;
故答案为:2;4;2;2;1;2;1:1;
点评 本题考查了氧化还原反应方程式配平及基本概念判断,准确判断方程式中各元素化合价变化,明确氧化还原反应得失电子守恒、原子个数守恒规律是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
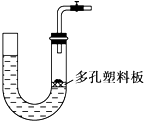
| A. | 大理石和稀硫酸制取二氧化碳 | B. | 锌粒和稀硫酸制氢气 | ||
| C. | 块状碳酸钠和稀盐酸制取二氧化碳 | D. | 氯酸钾和二氧化锰制取氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Al3+ | B. | Al3+ | C. | Fe2+、NH4+ | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫磺有杀虫、杀螨、杀菌作用 | |
| B. | 石膏可以用做雕像材料 | |
| C. | 碳酸钡常用于治疗胃病,俗称“钡餐” | |
| D. | 明矾可做净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
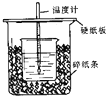 50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.
50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com