
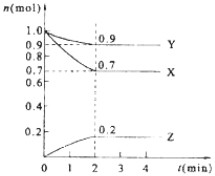
| ��c |
| ��t |
| �μӷ�Ӧ�����ʵ��� |
| ��ʼ���ʵ��� |
| Y�����ʵ��� |
| ƽ��ʱ������������ʵ��� |
| m(��) |
| n(��) |
 2Z���ʴ�Ϊ��3X+Y
2Z���ʴ�Ϊ��3X+Y  2Z��
2Z��| ��c |
| ��t |
| ||
| 2min |
| �μӷ�Ӧ�����ʵ��� |
| ��ʼ���ʵ��� |
| 1.0-0.7 |
| 1.0 |
| 1.0-0.9 |
| 1.0 |
| Y�����ʵ��� |
| ƽ��ʱ������������ʵ��� |
| 0.9 |
| 0.7+0.9+0.2 |
| m(��) |
| n(��) |
. |
| M |
| (0.7a+0.9b+0.2c)g |
| 0.9mol+0.7mol+0.2mol |
| 7a+9b+2c |
| 18 |
. |
| M |
| a+b |
| 1.8 |
| 7a+9b+2c |
| 18 |
| a+b |
| 1.8 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��CH4���ӵı���ģ�ͣ� |
B��CCl4�ĵ���ʽ��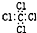 |
| C��H2O2�Ľṹʽ��H-O-O-H |
| D����������ʽ��C2H4O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� �� | ʳ�Ρ�����ء������ |
| �⺬�� | 35��15mg/kg |
| ���ط��� | �ܷ⡢�ܹ⡢���� |
| ʳ�÷��� | ���ʱ����ʳƷ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
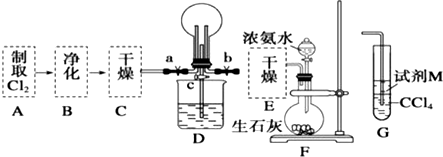

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�ͼ��1mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ
��1�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�ͼ��1mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ
|
| 3 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ijʵ��С���H2O2�ķֽ���������̽����
ijʵ��С���H2O2�ķֽ���������̽����| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| ���� ������ |
��������Ӧ | ��������Ӧ | ��������Ӧ | ��������Ӧ |
| ���� ���� |
360 | 480 | t | 720 |
| MnO2���� ���� |
10 | 25 | 60 | 120 |
| ���� MnO2 |
���� ��� |
�۲��� | ��Ӧ��� ����ʱ�� |
| ��ĩ״ | ��� ���� |
���ҷ�Ӧ�������ǵ�ľ����ȼ | 3.5min |
| ��״ | ��Ӧ���������Ǻ�����ľ��δ��ȼ | 30min |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��c��NH4+����ȵģ�NH4��2 S04��NH4HS04��NH4Cl��Һ�У�c��NH4 HS04����c[��NH4��2S04]��c��NH4Cl�� |
| B����֪HF�����Ա�CH3 COOH��ǿ��pH��ȵ�NaF��CH3COOK��Һ�У�c��Na+��-c��F-����c��K+��-c��CH3COO-�� |
| C�����������Һ�м����������ᣬ�õ������Ի����Һ�У�c��CH3 COO-����c��Na+����c��H+����c��OH-�� |
| D�����е����ʵ���NaClO��NaHC03����Һ�У�c��HClO��+c��ClO-���Tc�� HCO3?��+c��H2CO3 ��+2c��CO32?�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com