
【题目】向Na2CO3、NaHCO3的混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是

A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
C. b点对应的溶液中:Al3+、Fe3+,MnO4-、Cl-
D. d点对应的溶液中:F-、NO3-、Fe2+、Ag+
【答案】B
【解析】向Na2CO3、NaHCO3的混合溶液中逐滴加入稀盐酸,碳酸钠首先反应生成碳酸氢钠,然后碳酸氢钠再与盐酸反应产生二氧化碳气体,因此a点溶液中含有CO32-和HCO3-,b点全部为HCO3-,c点恰好完全反应生成NaCl,溶液呈中性,d点盐酸过量,呈酸性,则A.a点溶液中含有CO32-和HCO3-,HCO3-与OH-反应不能大量共存,A错误;B.c点恰好完全反应生成NaCl,溶液呈中性,离子之间不发生任何反应,可大量共存,B正确;C.b点全部为HCO3-,Al3+、Fe3+与HCO3-发生互促水解反应而不能大量共存,C错误;D.d点呈酸性,酸性条件下,NO3-与Fe2+发生氧化还原反应而不能大量共存,F-在酸性条件下不能大量共存,银离子与氯离子不能大量共存,D错误,答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.2mol水的摩尔质量是36g?mol﹣1
B.一个钠原子的实际质量约等于 ![]() ?g
?g
C.1.5mol O2的体积约为33.6L
D.将 100mL水加入到 100mL 1mol/L的NaOH溶液中,所得溶液为0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )

A.a为负极,b为正极
B.d为阳极,c为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料,0.25mol N2H4 (g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程式中正确的是( )
A. ![]() N2H4 (g) +
N2H4 (g) +![]() O2(g) =
O2(g) =![]() N2(g)+H2O (g) △H=+267kJ/mol
N2(g)+H2O (g) △H=+267kJ/mol
B. N2H4 (g) + O2(g) =N2(g)+2H2O (g) △H=-534kJ/mol
C. N2H4 (g) + O2(g) =N2(g)+2H2O (g) △H=+534kJ/mol
D. N2H4 (g) + O2(g) =N2(g)+2H2O (l) △H=-133.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 化学变化过程中一定伴随着能量变化 B. 放热反应可能需要加热才能进行
C. 吸热反应只能在加热条件下才能进行 D. 天然气在空气中燃烧时,能量转化形式不止一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,能用勒夏特列原理解释的是
A. 对CO(g)+NO2(g)![]() CO2(g) + NO(g)平衡体系增大压强可使顔色变深
CO2(g) + NO(g)平衡体系增大压强可使顔色变深
B. 对2SO2+O2![]() 2SO3 △H<0的反应,使用催化剂可加快反应的速率
2SO3 △H<0的反应,使用催化剂可加快反应的速率
C. 实验室可用浓氨水和氢氧化钠固体快速制取氨气
D. N2(g)+3H2(g)![]() 2NH3(g) △H<0,500℃左右比室温更有利于合成NH3
2NH3(g) △H<0,500℃左右比室温更有利于合成NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO![]() 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
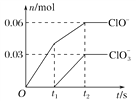
A. 反应中转移电子的物质的量是0.21 mol
B. ClO![]() 的生成可能是由于温度升高引起的
的生成可能是由于温度升高引起的
C. 标准状况下有3.36 L氯气参加反应
D. 苛性钾溶液中KOH的物质的量为0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖揭晓,美国科学家约翰·古迪纳夫、英裔美国科学家斯坦利·惠廷厄姆与日本科学家吉野彰共同获得此奖,以表彰他们在锂离子电池领域作出的突出贡献,其中用到的LiCoO2属于( )
A.氧化物B.碱C.盐D.酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com