
A、 制取氨气 |
B、 分离乙醇和乙酸乙酯混合液 |
C、 电解精炼铜 |
D、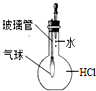 验证HCl极易溶于水 |


科目:高中化学 来源: 题型:
 金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )| A、绿原酸的分子式为C16H12O9 |
| B、绿原酸能和NaHCO3溶液发生反应放出CO2气体 |
| C、1mol绿原酸最多与8 molNaOH反应 |
| D、绿原酸分子中有4种化学环境不同的氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向CuSO4溶液中通入H2S气体,出现黑色沉淀 | H2S的酸性比H2SO4强 |
| B | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| C | 蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制氢氧化铜悬浊液,水浴加热,未出现红色沉淀 | 蔗糖未水解 |
| D | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 检验制得气体是否为乙烯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com