
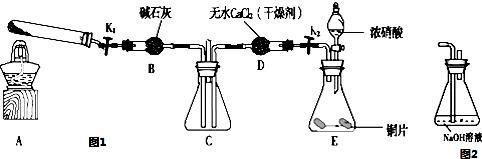
分析 (1)根据各物质的状态和性质来分析确定;
(2)若NO2能够被NH3还原,则混合气体的颜色将变浅;
(3)有毒气体不能直接排空;
(4)验证NO2能被Na2O2氧化,首先要制取二氧化氮,因为水能和过氧化钠反应,所以要除去水的干扰,使二氧化氮气体通过过氧化钠,最后要进行尾气处理;
(5)过氧化钠变成白色固体且为纯净物,根据氧化还原反应中元素化合价的变化确定生成物.
解答 解:(1)a.加热NH4HCO3时,碳酸氢铵分解生成氨气、水和二氧化碳,除去水和二氧化碳就可以得到氨气,故选;
b.加热NH4Cl时,氯化铵分解生成氨气和氯化氢,但温度低时,氨气和氯化氢又化合生成氯化铵,所以得不到氨气,故不选;
c.浓氨水是液体,试管中的药品是固体,所以不符合要求,故不选;
故选a;
(2)二氧化氮是红棕色气体,如果能被氨气还原,生成无色气体氮气,则C装置中混合气体颜色变浅,
故答案为:C装置中混合气体颜色变浅;
(3)二氧化氮是有毒气体,氨气是有刺激性气味的气体,所以都不能直接排空,要进行尾气处理才能排入空气,
故答案为:缺少尾气吸收装置;
(4)验证NO2能被Na2O2氧化,首先要用E装置制取二氧化氮,因为制取的二氧化氮气体中含有水蒸气,水能和过氧化钠反应而造成干扰,所以要用D装置除去水蒸气,然后较纯净的二氧化氮通过B装置,未反应的二氧化氮有毒不能直接排空,所以最后要进行尾气处理,选用F装置处理尾气,所以装置的合理连接顺序是EDBDF或EDBF或FDBDE或FBDE,
故答案为:EDBDF或EDBF或FDBDE或FBDE;
(5)B装置中淡黄色粉末逐渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成,过氧化钠作氧化剂,则二氧化氮中氮元素失电子化合价升高而作还原剂,所以氮元素只能转化为+5价,且生成物是纯净物,所以是硝酸钠,反应方程式为2NO2+Na2O2═2NaNO3,
故答案为:2NO2+Na2O2═2NaNO3.
点评 本题考查了探究二氧化氮性质的实验,根据元素的化合价来预测物质具有的性质,然后根据实验现象判断物质具有的性质,难度较大.


 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将20 g NaOH 溶解在500mL 水中 | |
| B. | 将22.4 L HCl 气体溶于水配成1 L 溶液 | |
| C. | 将1 L 10 mol•L-1浓盐酸加入9 L 水中 | |
| D. | 将10 g NaOH 溶解在少量水中,恢复至室温,再加蒸馏水直到溶液体积为250 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 148 g•mol-1 | B. | 24 g•mol-1 | C. | 74 g•mol-1 | D. | 40 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
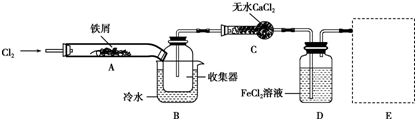
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和③ | B. | ③和④ | C. | ①和④ | D. | ①和② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com