
【题目】在反应3BrF3+5H2O===HBrO3+Br2+9HF+O2↑中,若有5 mol H2O作为还原剂时,被还原的BrF3的物质的量为( )
A. 3 mol B. 2 mol C. ![]() mol D.
mol D. ![]() mol
mol
【答案】B
【解析】
根据反应可知,2H2O作还原剂时,失电子为4mol,当BrF3中的溴元素从+3价降低为0价时,BrF3作氧化剂,被还原;然后根据1molBrF3 被还原时,要得到3mol电子,利用电子守恒进行计算;根据反应可知,2 mol水可还原4/3 mol BrF3,据此可以求出3 mol水还原的BrF3的物质的量。
设被水还原的BrF3的物质的量为x。根据电子守恒知:3 mol×2=x·3, 解得x=2 mol;或根据化学方程式可知,2 mol水可还原4/3 mol BrF3,那么,3 mol水还原的BrF3的物质的量为x。则:3 mol∶x=2 mol∶4/3 mol,解得x=2 mol;正确选项B。


科目:高中化学 来源: 题型:
【题目】W、X、Y、Z均为短周期主族元素,Y的原子序数是W和Z的原子序数之和的一半,Y原子的最外层电子数与核外电子总数之比为2:7;W和Z形成的可溶性化合物WZ溶于水中不能促进水的电离;W、X、Z三种元素形成的某种化合物能消毒杀菌.下列说法正确的是
A.四种元素原子中,原子半径最大的是Z
B.X、Y形成的化合物能溶于盐酸
C.最高价氧化物对应水化物的酸性:Z强于Y
D.1molW单质与足量X单质反应,转移的电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、能源、环境等密切相关。下列叙述正确的是( )
A.油脂和蛋白质是人体必需的营养物质,都属于高分子化合物
B.食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是吸水防止食品变质
C.采用催化转化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毒气体
D.中医古籍![]() 肘后备急方
肘后备急方![]() 中“青蒿一握,以水二升渍,绞取汁,尽服之”启发了屠呦呦采用低温提取青蒿素,该提取过程属于化学变化
中“青蒿一握,以水二升渍,绞取汁,尽服之”启发了屠呦呦采用低温提取青蒿素,该提取过程属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用如图所示装置制取(必要时可加热)、净化、收集的气体是
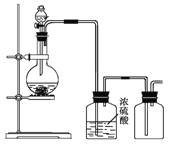
A.亚硫酸钠固体与硫酸反应制二氧化硫
B.氯化铵与氢氧化钙固体反应制氨气
C.锌和稀硫酸反应制氢气
D.铜与稀硝酸反应制一氧化氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]()
![]() +OH
+OH
C. 由Na和C1形成离子键的过程:![]()
D. 电解精炼铜的阴极反应:Cu2+ +2e![]() Cu
Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的是纯净物、单质、化合物、含氧化合物、氧化物、碱之间的包含、不包含关系,若整个大圆圈代表纯净物,则下列选项中,能正确指出①、②、③、④、⑤所属物质类别的是( )
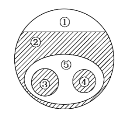
A. ①单质、③化合物
B. ②碱、⑤氧化物
C. ④碱、⑤含氧化合物
D. ④含氧化合物、③氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年,三鹿等多家乳制品企业为使蛋白质含量检测合格而加入三聚氰胺,使多名儿童患肾结石,实验室可用下列实验装置测定三聚氰胺的分子式。
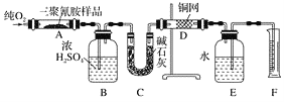
已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成二氧化碳、水、氮气,实验测得装置B增重0.54g,C增重1.32g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是_____。
(2)需要加热的装置是____(填字母代号)。
(3)装置D的作用是_____。
(4)F处读数时应该注意的是____、_____。
(5)三聚氰胺的分子式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究Cl2和NO2在NaOH溶液中的反应,若通入适当比例的Cl2和NO2,即发生反应Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。
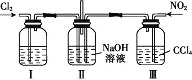
下列叙述正确的是
A. 实验室中用二氧化锰与3 mol·L-1的盐酸共热制备氯气
B. 装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气
C. 装置Ⅲ的作用是便于控制通入NO2的量
D. 若制备的NO2中含有NO,应将混合气体通入水中以除去NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铁生锈的过程为:Fe→Fe(OH)2→Fe(OH)3→Fe2O3xH2O.又知草酸(H2C2O4)分解的化学方程式为 H2C2O4![]() CO↑+CO2↑+H2O,某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
CO↑+CO2↑+H2O,某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲同学利用草酸分解产生的混合气体和如所示装置测定其中一种锈铁的组成。
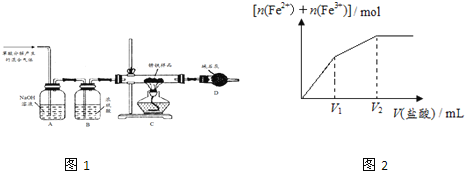
主要操作为:取锈铁样品12.6g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4g,装置D增重8.4g。
①钢铁在潮湿空气中发生电化学腐蚀时,其负极的电极反应式为 ______ 。
②装置A的作用是 ______ ,装置B的作用是 ______ 。
③根据以上数据能否测定出锈铁的组成?答: ______ (填“能”或“不能”)。
④该装置还存在的一个明显的缺陷是 ______ 。
(2)乙同学在甲同学装置的基础上将装置D换成装浓硫酸的洗气瓶(装置E,此装置图略),经改进后,重新按甲同学的操作和样品取用量进行实验,若完全反应后得到固体的质量仍为8.4g,而装置E增重1.8g,则x= ______ ;m(Fe):m (Fe2O3xH2O)= ______ 。
(3)丙同学取少量的另外一种锈铁片放在烧杯中,然后逐滴加入稀盐酸,实验测知所得溶液中Fe2+、Fe3+的物质的量之和与加入稀盐酸的体积关系如图2示,此锈铁中n(Fe):n(Fe2O3xH2O)的取值范围是 ______ 。(填字母)
a.大于1 b.等于1 c.小于1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com