

| 容器编号 | 实验条件 | 平衡时反应中的能量变化 |
| Ⅰ | 恒温恒容 | 放热Q1kJ |
| Ⅱ | 恒温恒压 | 放热Q2kJ |
| Ⅲ | 恒容绝热 | 放热Q3kJ |
分析 (1)根据盖斯定律,①×2+②可得③,反应热也进行相应计算;
(2)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
设转化的氮气为xmol,表示出平衡时各物质的物质的量,再根据M点NH3的体积分数为10%列方程计算解答;
(3)随Y值增大,φ(NH3)减小,平衡N2(g)+3H2(g)?2NH3(g)△H<0向逆反应方向移动,正反应为体积减小的放热反应,故Y为温度,则X为压强,增大压强平衡正向移动,φ(NH3)增大;
(4)A.I为恒温恒容,随反应进行压强减小,Ⅱ为恒温恒压,Ⅱ等效为在I的基础上增大压强,平衡正向移动,Ⅱ中反应物转化率大于Ⅰ;
B.Ⅲ为恒容绝热,随反应进行温度升高,I为恒温恒容,Ⅲ等效为在I的基础上升高温度,平衡逆向移动;
C.平衡常数只受温度影响,温度相同,平衡常数相同;
D.Ⅱ等效为在I的基础上增大压强,平衡正向移动,氨气体积分数增大;
(5)溶液呈中性,则c(H+)=c(OH-),根据电荷守恒:c(NH4+)+c(H+)=2c(SO42-)+c(OH-);
(6)原电池负极发生氧化反应,氨气在负极失去电子,与电解质氧化传导的O2-结合生成氮气与水.
解答 解:(1)已知:①NH3(l)?NH3(g)△H1
②N2(g)+3H2(g)?2NH3(l)△H2
根据盖斯定律,①×2+②可得:N2(g)+3H2(g)?2NH3(g),故△H=2△H1+△H2,
故答案为:2△H1+△H2;
(2)反应N2(g)+3H2(g)?2NH3(g)的平衡常数表达式K=$\frac{{c}^{3}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,
设转化的氮气为xmol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):1 3 0
转化量(mol):x 3x 2x
平衡量(mol):1-x 3-3x 2x
所以$\frac{2x}{4-2x}$=10%,解得x=$\frac{2}{11}$mol,故氮气转化率为$\frac{\frac{2}{11}mol}{1mol}$×100%=18%,
故答案为:$\frac{{c}^{3}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;18%;
(3)随Y值增大,φ(NH3)减小,平衡N2(g)+3H2(g)?2NH3(g)△H<0向逆反应方向移动,正反应为体积减小的放热反应,故Y为温度,则X为压强,增大压强平衡正向移动,φ(NH3)增大,a点的数值比b点小,
故答案为:小;温度;随Y值增大,φ(NH3)减小,平衡N2(g)+3H2(g)?2NH3(g)△H<0向逆反应方向移动,故Y为温度;
(4)A.I为恒温恒容,随反应进行压强减小,Ⅱ为恒温恒压,Ⅱ等效为在I的基础上增大压强,平衡正向移动,Ⅱ中反应物转化率大于Ⅰ,放出热量:Ql<Q2,故A正确;
B.Ⅲ为恒容绝热,随反应进行温度升高,I为恒温恒容,Ⅲ等效为在I的基础上升高温度,平衡逆向移动,N2的转化率:I>III,故B正确;
C.平衡常数只受温度影响,温度相同,平衡常数相同,则平衡常数:II=I,故C错误;
D.Ⅱ等效为在I的基础上增大压强,平衡正向移动,则达平衡时氨气的体积分数:I<II,故D错误,
故答案为:AB;
(5)溶液呈中性,则c(H+)=c(OH-),根据电荷守恒:c(NH4+)+c(H+)=2c(SO42-)+c(OH-),则c(NH4+)>c(SO42-),
故答案为:>;
(6)原电池负极发生氧化反应,氨气在负极失去电子,与电解质氧化传导的O2-结合生成氮气与水,负极电极反应式为:2NH3+3O2--6e-=N2+3H2O,
故答案为:2NH3+3O2--6e-=N2+3H2O.
点评 本题考查化学平衡计算与影响因素、反应热计算、离子浓度比较、原电池等知识,题目难度较大,注意熟练掌握盖斯定律在反应热计算中的应用方法,明确化学平衡较强影响因素,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁制容器可盛装冷的浓硫酸,因为常温下铁和浓硫酸不反应 | |
| B. | Na2O2用作呼吸面具的供氧剂 | |
| C. | 欲鉴别FeCl2溶液、AlCl3溶液和AgNO3溶液,向3种待测液中分别滴加足量氨水 | |
| D. | 铝热反应需提供一定的能量引发,因为铝热反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
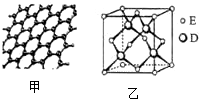 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .P元素属于p区元素,
.P元素属于p区元素,
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
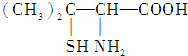
| A. | 青霉氨基酸分子中所有碳原子均在同一直线上 | |
| B. | 青霉氨基酸具有两性并能发生酯化反应 | |
| C. | 青霉氨基酸分子间不能发生缩合反应 | |
| D. | 1 mol青霉氨基酸与足量的金属钠反应生成0.5 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com