
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
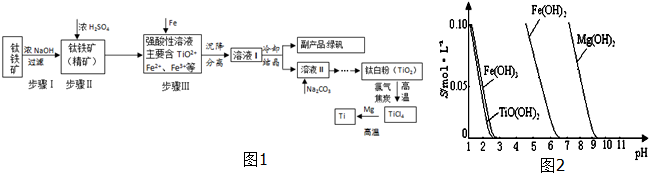
分析 钛铁矿用氢氧化钠溶液溶解,氧化铝、二氧化硅反应溶解,过滤得到钛铁矿精矿中主要含有FeTiO3、FeO,再用浓硫酸处理,得到强酸性溶液中含有TiOSO4、FeSO4及未反应的硫酸等,由图1可知TiO(OH)2与Fe(OH)3沉淀的pH很接近,所以加入铁粉目的是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀,沉降分离得到溶液中主要含有Fe2+、TiO2+及硫酸根,再浓缩蒸发得到绿矾与溶液Ⅱ,溶液Ⅱ中含有TiOSO4,加入碳酸钠溶液,调节pH接近3,TiO(OH)2沉淀完全,再经过系列操作得到Ti.
(1)钛铁矿精矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成,依据氧化还原反应分析,应生成硫酸亚铁和水;
(2)步骤Ⅲ加入铁屑,将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀,调节pH接近3,TiO(OH)2沉淀完全;
(3)TiO2+易水解,只能存在于强酸性溶液中,所以TiO2+水解生成TiO(OH)2与H+;加入碳酸钠溶液,促进TiO2+水解,调节pH接近3,TiO(OH)2沉淀完全;
(4)钛白粉与氯气、焦炭在高温下进行反应,还生成一种可燃性无色气体,应为CO,反应的化学方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,TiOSO4发生水解生成硫酸;
(5)控制稳定使混合物中Mg、MgCl2转化为气态,而Ti不能转化为气态;
(6)灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面放酒精灯,用玻璃棒搅拌防止局部受热固体飞溅;
解答 解:钛铁矿用氢氧化钠溶液溶解,氧化铝、二氧化硅反应溶解,过滤得到钛铁矿精矿中主要含有FeTiO3、FeO,再用浓硫酸处理,得到强酸性溶液中含有TiOSO4、FeSO4及未反应的硫酸等,由图1可知TiO(OH)2与Fe(OH)3沉淀的pH很接近,所以加入铁粉目的是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀,沉降分离得到溶液中主要含有Fe2+、TiO2+及硫酸根,再浓缩蒸发得到绿矾与溶液Ⅱ,溶液Ⅱ中含有TiOSO4,加入碳酸钠溶液,调节pH接近3,TiO(OH)2沉淀完全,再经过系列操作得到Ti.
(1)钛铁矿精矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成,依据氧化还原反应分析,应生成硫酸亚铁和水,反应的化学方程式为:FeTiO3+H2SO4(浓)=TiOSO4+FeSO4+2H2O,
故答案为:FeTiO3+H2SO4(浓)=TiOSO4+FeSO4+2H2O;
(2)由图可知,pH=3时TiO(OH)2已沉淀完全,由图可知TiO(OH)2与Fe(OH)3沉淀的pH很接近,所以加入铁粉目的是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀,
故答案为:3,将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀;
(3)水解过程是吸热反应,加热促进TiO2++2H2O?TiO(OH)2+2H+ 右移,TiO2+易水解,只能存在于强酸性溶液中,所以TiO2+水解生成TiO(OH)2与H+,离子方程式为:TiO2++2H2O?TiO(OH)2+2H+;加入碳酸钠溶液后得到TiO(OH)2沉淀,所以向溶液Ⅱ中加入Na2CO3粉末的作用是:调节溶液pH值,促进TiO2+水解,
故答案为:加热促进TiO2++2H2O?TiO(OH)2+2H+ 右移; Na2CO3粉末消耗H+,促进TiO2+水解;
(4)钛白粉与氯气、焦炭在高温下进行反应,还生成一种可燃性无色气体,应为CO,反应的化学方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,TiOSO4发生水解生成硫酸,可以循环使用的物质为H2SO4,
故答案为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;H2SO4.
(5)Mg、MgCl2的沸点最高是1412℃,而Ti的熔点为1667℃,所以当温度略高于1412℃时Mg、MgCl2以气体的形式除去,而得到Ti,
故答案为:1412;
(6)灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面放酒精灯,用玻璃棒搅拌防止局部受热固体飞溅,在灼烧时需要仪器除了三脚架、坩埚、石棉网、坩埚钳、酒精喷灯外还需要泥三角、玻璃棒,
故答案为:泥三角、玻璃棒.
点评 本题综合考查物质制备实验、物质分离提纯、对操作的分析评价、电解原理等,注意分析工艺流程中试剂线、原理线、操作线,要求学生具有一定分析和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:解答题

 ,A的二氯取代物有1种.
,A的二氯取代物有1种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(HCOO-)>c(Na+) | B. | c(HCOOH)<c(HCOO-) | ||
| C. | c(HCOOH)+c(HCOO-)=0.02mol•L-1 | D. | 2c(H+)+c(HCOOH)=c(HCOO-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和食盐水 | B. | 0.1mol•L-1的盐酸 | ||
| C. | 0.1 mol•L-1 的CaCl2 溶液 | D. | 新制的饱和氯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 3v逆(C)=2v正(B) | D. | 气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
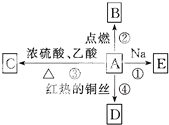 A是化学实验室中最常见的有机物,能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,能进行如图所示的多种反应. CH3COOCH2CH3+H2O;反应④2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
CH3COOCH2CH3+H2O;反应④2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(l)△H=-483.6 kJ•mol-1,则 2molH2(g)和1molO2(g)所含有的总能量比2mol H2O(l)所含有的总能量少483.6kJ | |
| B. | 己知2C(s)+2O2(g)═2CO2(g)△H12C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 | |
| C. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 利用盖斯定律可以间接计算通过实验难以测定反应的反应热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com