
铬是一种重金属,铬超标对环境和人类有很大的危害,高价态铬对人体的毒性非常强,对肝、肾等内脏器官和DNA造成损伤,在人体内蓄积具有致癌性并可能诱发基因突变等。
(1)某电镀厂用生铁将废水中的Cr2O72-转化为Cr3+,并进一步从废水中除去,其流程图如下:

① 气体A是 。
② 在上述酸性溶液中,生铁比纯铁产生Fe2+的速率快,原因是 。
③ 将Cr3+转化为Cr(OH)3的离子方程式是 。
(2)电解法将一定浓度的酸性废水中的Cr2O72-转化为Cr3+,其原理示意图如下:

① 阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式是 。
② 一段时间后,试管底部出现沉淀。解释生成沉淀的原因:
。
【考点】本题考查较为综合,涉及电解、氧化还原反应等问题,题目难度中等。
【解析】(1)①铁与硫酸反应生成H2,故答案为:H2;②生铁中含有C,铁和碳在硫酸溶液中形成原电池,故答案为:生铁中含有C,在硫酸溶液中形成无数微小原电池,加快反应速率;③Cr3+与石灰乳反应生成Cr(OH)3是沉淀,离子方程式是2Cr3++3Ca(OH)2═2Cr(OH)3↓+3Ca2+,故答案为:2Cr3++3Ca(OH)2═2Cr(OH)3↓+3Ca2+;
(2)①铁作阳极,电极本身被氧化,反应式为Fe-2e-═Fe2+,溶液呈酸性,H+离子在阴极放电生成氢气,反应式为2H++2e═H2↑,Fe2+离子与Cr2O72-离子发生氧化还原反应生成Fe3+离子和Cr3+离子,反应离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
②随着电解进行,c(OH-)浓度增大,生成Fe(OH)3和Cr(OH)3沉淀,故答案为:随着电解进行,溶液中c(H+) 逐渐减少,c(OH-)浓度增大,生成Fe(OH)3和Cr(OH)3沉淀。
【答案】(8分)
(1)① H2 (1分)
②生铁中含有C,在硫酸溶液中形成无数微小原电池,加快反应速率(1分)
③2Cr3+ + 3Ca(OH)2 = 2Cr(OH)3 ↓+3Ca2+(2分)
(2)① 6Fe2+ +Cr2O72- + 14H+ = 6Fe3+ +2Cr3+ + 7H2O (2分)
② 随着电解进行,溶液中c(H+) 逐渐减少,c(OH- )浓度增大,生成Fe(OH)3和Cr(OH)3沉淀(2分)


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
物质分类的依据通常有组成和性质。下列物质分类中,只考虑组成的是
A.Na2SO4是钠盐、硫酸盐、正盐
B.HNO3是一元酸、强酸、挥发性酸
C.Mg(OH)2是二元碱、难溶性碱、中强碱
D.Al2O3是两性氧化物、金属氧化物、最高价氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
为节省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液、直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),通过巧妙的构思,设计了比较铜、锌金属活动 性相对强弱的系列实验。试填写下列空白:
性相对强弱的系列实验。试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),向烧杯中小心加入稀硫酸,观察到的现象是________。甲同学的设计思路是_____________________________。
(2)乙同学接着甲的实验,向烧杯中滴加________溶液,进而观察到的现象是____________________________________________________________ ____________。
____________。
乙同学作出锌、铜金属活动性相对强弱的结论所依据的原理是____________________________________________________________________。
(3)丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了必要的试剂________ 溶液(作为电解液)。反应在调控下随即开始,实验中有关反应的化学方程式为________________________。实验中的明显现象是____ ____________________。
____________________。
(4)请你再单独设计一个简单的实验(试剂、仪器自选),探究和证实锌、铜金属活动性的相对强弱(简要说明操作和现象)______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室利用如右图装置进行中和热的测定。
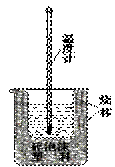 回答下列问题:
回答下列问题:
①如图装置中,为了酸碱能更充分地反应,应该增加一个 (填玻璃仪器名称);大烧杯上没有盖上硬纸板,测得的中和热数值将会
(填“偏大”、“偏小”或“无影响”)。
②在操作正确的前提下提高中和热测定的准确性的关键是 ( 填代号)
A.进行实验时的气温
B.装置的保温隔热效果
C.实验所用酸碱溶液的体积
③如果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数值将 (填“偏大”、“偏小”、“不变”);原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2CrO42-(黄色)+2H+  Cr2O72-(橙色)+H2O。现以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下(阳离子交换膜只允许阳离子通过):
Cr2O72-(橙色)+H2O。现以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下(阳离子交换膜只允许阳离子通过):
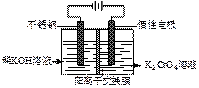
下列说法不正确的是
A.在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为产生的H+,与CrO42-离子反应使2CrO42-+2H+  Cr2O72-+H2O向右进行
Cr2O72-+H2O向右进行
C.该制备过程总反应的化学方程式为:
4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑
2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr )为d,则此时铬酸钾的转化率为1-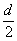
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关浓硫酸与浓硝酸的叙述,不正确的是
A.露置空气中,两者浓度均降低 B常温下,两者均能使铁、铝钝化
C.一定条件下,两者均能与铜反应 D两者都具有强氧化性,均能氧化SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解尿素[CO(NH2)2]的碱性溶液制氢,装置如下图所示,电解池中的隔膜仅阻止气体通过。电解时总的化学方程式为:
CO(NH2)2+2OH-通电CO32-+N2↑+3H2↑
以下说法不正确的是
A.a为阳极,b为阴极
B.电解时,溶液中OH—向b极移动
C.阴极反应式:2H2O+2e-===H2↑+2OH-
D.电解后,溶液pH减小

查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、NH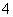 、Mg2+、Al3+、Fe3+、CO
、Mg2+、Al3+、Fe3+、CO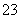 、SO
、SO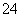 、NO
、NO 中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是

A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH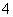 )=0.2 mol
)=0.2 mol
C.溶液中一定不含CO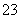 ,可能含有SO
,可能含有SO 和NO
和NO
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com