
| A. | 该物质在液态时能导电 | B. | 该物质在水溶液中能导电 | ||
| C. | 该物质能溶于水 | D. | 该物质具有较高的熔、沸点 |
分析 含有离子键的化合物是离子化合物,离子化合物在熔融状态下以阴阳离子存在,共价化合物在熔融状态下以分子存在,所以可以根据熔融状态是否达到判断离子键,据此分析解答.
解答 解:A.该化合物在液态时能导电,说明含有自由移动阴阳离子,则该化合物的构成微粒是阴阳离子,一定含有离子键,故A错误;
B.在水溶液中能导电的化合物不一定含有离子键,如硫酸等,故B错误;
C.能溶于水的化合物不一定含有离子键,如HCl、氨气等,故C错误;
D.熔沸点较高的化合物不一定含有离子键,如二氧化硅等,故D错误;
故选A.
点评 本题考查离子化合物和共价化合物的判断,侧重考查基本概念,明确离子键和共价键的根本区别是解本题关键,注意不能根据溶解性、熔沸点判断离子化合物,易错选项是B.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | n(Fe)<n(S),总质量等于44 g | B. | n(Fe)>n(S),总质量小于44 g | ||
| C. | n(Fe)=n(S),总质量大于44 g | D. | n(Fe)>n(S),总质量等于44 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有些物质是由分子直接构成的,化学式能准确表示该物质分子组成,如白磷(P4)、二氧化碳(CO2)、氯化铵(NH4Cl)等 | |
| B. | C2H2与BeCl2分子中的中心原子杂化轨道的类型相同 | |
| C. | 在1molSiO2晶体中,含有2molSi-O键 | |
| D. | NC13分子中N-C1键键长比CCl4分子中C-C1键键长长 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
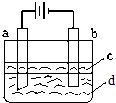 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
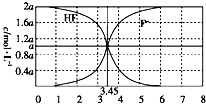 25℃时,用NaOH粉末调节2a mol•L-1的氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用NaOH粉末调节2a mol•L-1的氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | 根据曲线可得Ka(HF)=0.01 | |
| B. | 当pH=3时,c(Na+)>c(F-) | |
| C. | 当pH=3.45时,2c(Na+)=c(F-)+c(HF) | |
| D. | 当pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)=2a mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
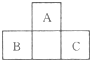 如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则:
如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则: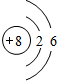 ,C的离子结构示意图:
,C的离子结构示意图: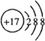
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Ⅰ操作 | Ⅱ结论 | |
| A | 滴加BaC12溶液生成白色沉淀 | 原溶液中有SO42- |
| B | 用洁净铂丝蘸取溶液进行焰色反应:火焰呈黄色 | 原溶液中有Na+无K+ |
| C | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液中无NH4+ |
| D | 滴加氯水和CC14,振荡、静置.下层溶液显紫色 | 原溶液中有I- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com