
【题目】某化学兴趣小组欲用下列装置制备氯水并探究其性质。完成下列填空:
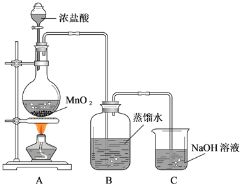
(1)C 装置的作用是________________。
(2)氯水制备完成后,甲同学从B中取出一定量的样品置于日光下照射一段时间,发现样品某些性质发生了明显的变化,请各列举一项:
物理性质变化:________________;
化学性质变化:________________。
(3)为证明氯气与水反应产物具有漂白性,丁同学将A中产生的气体缓缓通过下列装置:

试剂 a 应选择_____; 试剂 b 应选择_____。
(4)戊同学从B中取出少量样品,滴到 NaHCO3 粉末上,有无色气泡产生,由此他认为氯气与水反应至少产生一种酸性强于碳酸的物质。请评价他的观点是否正确并说明理由 ________________。
【答案】吸收多余氯气 溶液颜色变浅 溶液酸性增强(或漂白性减弱等) CaCl2 碱石灰 不正确,因为A中会挥发出HCl进入B中,使溶液中存在盐酸。
【解析】
用MnO2与浓盐酸在加热条件下反应制Cl2,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;制得的Cl2通入水中,将制得氯水,呈黄绿色,里面含有Cl2、HCl、HClO等,由于浓盐酸能挥发出HCl随Cl2一起逸出,所以氯水中的HCl有一部分来自盐酸;HCl具有酸性,HClO具有漂白性,但见光易分解,应避光保存;但Cl2本身没有漂白性。
MnCl2+Cl2↑+2H2O;制得的Cl2通入水中,将制得氯水,呈黄绿色,里面含有Cl2、HCl、HClO等,由于浓盐酸能挥发出HCl随Cl2一起逸出,所以氯水中的HCl有一部分来自盐酸;HCl具有酸性,HClO具有漂白性,但见光易分解,应避光保存;但Cl2本身没有漂白性。
(1)氯气是大气污染物,需进行处理,由此得出C 装置的作用是吸收多余氯气,防止污染环境。答案为:吸收多余氯气;
(2)光照后,氯水中HClO不断分解,促使Cl2不断与水反应,若时间足够长,最后氯水变为稀盐酸。物理性质变化:溶液颜色变浅;
化学性质变化:溶液酸性增强(或漂白性减弱等)。答案为:溶液颜色变浅;溶液酸性增强(或漂白性减弱等);
(3)从图中可能看出,试剂a的作用是吸收水蒸气,且呈固态,所以试剂 a 应选择无水CaCl2;试剂 b 应能吸收Cl2,所以应选择碱石灰。答案为:CaCl2;碱石灰;
(4)前面已经分析,HCl不仅可以来自Cl2与水的反应,还可来自盐酸挥发出的HCl。戊同学的观点不正确,因为A中会挥发出HCl进入B中,使溶液中存在盐酸。答案为:不正确,因为A中会挥发出HCl进入B中,使溶液中存在盐酸。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属。
请回答下列问题:![]() 用推出的元素符号或者化学式作答
用推出的元素符号或者化学式作答![]()
(1)F的价电子排布式为__,B、C、D三种元素的第一电离能从大到小的顺序为___,D和E电负性较大的是__。
(2)BD32-中B原子的杂化方式为__,该离子的空间构型为__,键角为___。
(3)写出一种由A、C、D组成且既含离子键又含共价键的物质的化学式__,化合物ABC中σ键和π键数目之比为___,C的气态氢化物在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因__。
(4)B和C的最高价含氧酸的酸性较强的是___,过量的G与C的最高价含氧酸稀溶液反应的离子方程式为__。
(5)E和G形成的某种晶胞如图所示:其中白球表示E,黑球表示G。则该物质的化学式为___,假设该晶胞的密度为ρg/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的G原子之间的距离为___cm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种锂离子电池,在室温条件下可进行循环充放电,实现对磁性的可逆调控。一极为纳米Fe2O3,另一极为金属锂和石墨的复合材料,电解质只传导锂离子。电池总反应为:Fe2O3+6Li![]() 2Fe+3Li2O,关于此电池,下列说法不正确的是
2Fe+3Li2O,关于此电池,下列说法不正确的是
A.放电时,此电池逐渐靠近磁铁
B.放电时,正极反应为Fe2O3+6Li++6e-= 2Fe+3Li2O
C.放电时,正极质量减小,负极质量增加
D.充电时,阴极反应为Li++e-=Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图分别表示红磷、白磷燃烧时的能量变化,有关说法正确的是( )

A.白磷比红磷稳定
B.白磷燃烧产物比红磷燃烧产物稳定
C.1mol 白磷转变为红磷放出 2244.7kJ 的热量
D.红磷燃烧的热化学方程式:4P(s)+5O2(g)→P4O10(s)+2954kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol/L二元弱酸H2A溶液中滴加0.1mol/LNaOH溶液,溶液中的H2A、HA-、A2 -的物质的量分数δ(x)随pH的变化如图所示。下列说法错误的是

A.pH =1.9时,c(Na+)<c(HA-)+2c(A2-)
B.当c(Na+)=c(H2A)+c(HA-)+c(A2-)时,溶液pH>7
C.pH=6时,c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.lg[Ka2(H2A)]=-7.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第________族。
(2)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸气,蒸气经冷却而得高纯度淡水。由此可判断蒸馏法是________________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式:食盐+H2O―→NaOH+H2↑+Cl2↑(未配平),该反应中食盐的化学式是________________________;利用电解所得气体制36.5%的浓盐酸1 000 t,最少需消耗食盐________ t。
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:
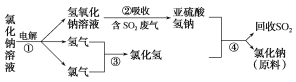
请写出②④的化学反应方程式:______,________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分MnO2,它们都含有少量Fe2O3、SiO2等杂质。工业上综合利用这两种矿物制备硫酸铜、硫酸锰和硫单质的主要工艺流程如下:

(1)浸取2过程中温度控制在500C~600C之间的原因是__________________。
(2)硫酸浸取时,Fe3+对MnO2氧化Cu2S起着重要催化作用,该过程可能经过两岁反应完成,将其补充完整:
①_____________________________(用离子方程式表示)
②MnO2+2Fe2++4H+= Mn2++2Fe3++2H2O
(3)固体甲是一种碱式盐,为测定甲的化学式,进行以下实验:
步骤1:取19.2 g固体甲,加足量的稀盐酸溶解,将所得溶液分为A、B两等份;
步骤2:向A中加入足量的NaOH溶液并加热,共收集到0.448L NH3(标准状况下)过滤后将所得滤渣洗涤干燥并灼烧至质量不再变化,可得4.80g红棕色固体残渣:
步骤3:向B中加入足量的BaCl2溶液,过滤、洗涤、干燥,可得9.32g固体残渣。
则固体甲的化学式为_________________
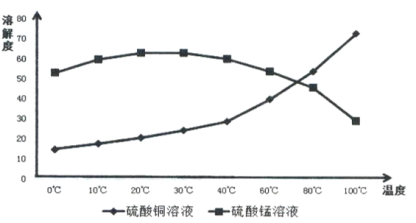
(4)相关物质的溶解度如下图,从除铁后的溶液中通过一系列的操作分别获得硫酸铜、硫酸锰晶体,请给出合理的操作顺序(从下列操作中选取,按先后次序列出字母,操作可重复使用):溶液→( ) →( )→( ) →(A) →( ) →( ) →( ),_____________
A.蒸发溶剂 B.趁热过滤 C.冷却结晶 D.过滤
E.将溶液蒸发至溶液表面出现晶膜 F.将溶液蒸发至容器底部出现大量晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,装置正确且设计合理的是
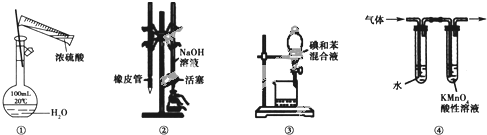
A.图![]() 所示装置进行浓硫酸稀释配制稀硫酸的实验
所示装置进行浓硫酸稀释配制稀硫酸的实验
B.图![]() 所示装置进行用已知浓度为NaOH溶液测定盐酸浓度的实验
所示装置进行用已知浓度为NaOH溶液测定盐酸浓度的实验
C.图![]() 所示装置进行用苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗下口倒出
所示装置进行用苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗下口倒出
D.图![]() 所示装置可检验溴乙烷发生消去反应得到的气体中含有乙烯
所示装置可检验溴乙烷发生消去反应得到的气体中含有乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com