
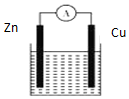
| A. | 产生1 g H2,消耗锌的质量65 g | |
| B. | 供电时的总反应为:Zn+2H+═Zn2++H2↑ | |
| C. | 该装置不可实现化学能全部转化为电能 | |
| D. | 铜做正极发生还原反应 |
分析 锌比铜活泼,锌为负极,发生氧化反应,铜为正极,发生还原反应,原电池工作时总反应为:Zn+H+=Zn2++H2↑,原电池是化学能转化为电能的装置,以此解答该题.
解答 解:A.原电池工作时总反应为:Zn+2H+=Zn2++H2↑,产生1gH2,消耗锌的质量32.5g,故A错误;
B.原电池工作时总反应为:Zn+2H+=Zn2++H2↑,故B正确;
C.该装置为原电池,原电池是化学能转化为电能的装置,但伴随发热等现象,所以不可实现化学能全部转化为电能,故C正确;
D.铜做正极,得电子发生还原反应,故D正确;
故选A.
点评 本题考查原电池知识,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,有利于培养学生的良好的科学素养,提高学习的积极性,难度不大,注意把握原电池的工作原理.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 能发生催化氧化反应 | |
| B. | 不能发生水解反应 | |
| C. | 1mol该有机物能与足量金属钠反应生成2gH2 | |
| D. | 1mol该有机物能与足量碳酸氢钠反应生成2 molCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | U | W | Y | X |  |
| ① | Na | H2O | Na2O2 | NaOH | |
| ② | Fe | H2O | C | H2 | |
| ③ | HBr | Cl2 | H2O | HC1 | |
| ④ | CuCl2 (aq) | A1 | HCl(aq) | AlCl3(aq) |
| A. | ②④ | B. | ②③ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多糖、蛋白质都是高分子化合物,一定条件下都能水解 | |
| B. | 普通玻璃、钢化玻璃和有机玻璃都是硅酸盐制品 | |
| C. | 分馏、干馏都是物理变化,裂化、裂解都是化学变化 | |
| D. | 尼龙绳、羊绒衫和棉衬衣等生活用品都是由合成纤维制造的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )| A. | 化学方程式为:2M?N | B. | t2时,正逆反应速率相等,达到平衡 | ||
| C. | t3时,正反应速率等于逆反应速率 | D. | t1时,N的浓度是M浓度的3倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能溶于水 | B. | 能使溴水褪色 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 能发生聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com