
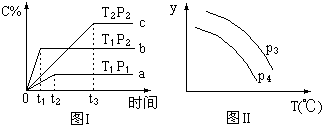
 在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )| A. | P3>P4,y轴表示A的物质的量 | |
| B. | P3<P4,y轴表示B的体积分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3>P4,y轴表示混合气体的平均相对分子质量 |
分析 根据图1可知,先拐先平衡条件高,T1>T2,升高温度,C的含量下降,说明平衡逆向移动,所以该反应正反应为放热反应,P2>P1,增大压强,C的含量增大,平衡正向移动,说明反应是气体体积减小的反应,故X=1,据此结合图2答题.
解答 解:根据图1可知,先拐先平衡条件高,T1>T2,升高温度,C的含量下降,说明平衡逆向移动,所以该反应正反应为放热反应,P2>P1,增大压强,C的含量增大,平衡正向移动,说明反应是气体体积减小的反应,故X=1,
A、由于该反应是体积减小的反应,增加压强平衡正向移动,A的物质的量减小,P3线应在下方,故A错误;
B、由于该反应是体积减小的反应,增加压强平衡正向移动,B的体积分数下降,P4线应在下方,又升高温度,平衡逆向移动,则B的体积分数增大,故B错误;
C、由于该反应前后气体质量守恒,容器体积不变,所以密度不变,故C错误;
D、由于该反应是体积减小的反应,增加压强平衡正向移动,总物质的量减小,气体质量守恒,所以平均相对分子质量增大,升高温度,平衡逆向移动,所以平均相对分子质量减小,故D正确;
故选D.
点评 本题主要考查了平衡移动的影响因素,中等难度,解题的关键在于抓住图象中先拐先平的特点分析问题.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:填空题
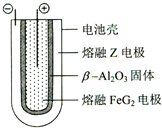 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子,G不是稀有气体元素.请回答下列问题:
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子,G不是稀有气体元素.请回答下列问题: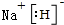 ;ZX与水反应放出气体的化学方程式为2NaH+H2O=2NaOH+H2↑.
;ZX与水反应放出气体的化学方程式为2NaH+H2O=2NaOH+H2↑. Fe+2ZG,放电时,电池的正极反应式为Fe2++2e-=Fe,该电池的电解质为β-Al2O3.
Fe+2ZG,放电时,电池的正极反应式为Fe2++2e-=Fe,该电池的电解质为β-Al2O3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、NO3-、SO42- | B. | Al3+、NO3-、SO42-、AlO2- | ||
| C. | OH-、HCO3-、Cl-、K+ | D. | Fe3+、K+、SCN-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二种 | B. | 三种 | C. | 四种 | D. | 五种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )| A. | 往平衡体系中加入少量金属铅后,c(Pb2+)增大 | |
| B. | 往平衡体系中加入少量 Sn(NO3)2固体后,c(Pb2+)变小 | |
| C. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 | |
| D. | 25℃时,该反应的平衡常数K=2.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 豆浆中加入石膏做豆腐 | |
| B. | 在河流入海口处易形成三角洲 | |
| C. | 在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 | |
| D. | 清晨的阳光穿过茂密的林木枝叶产生美丽的光线 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com