
若用浓度0.2 mol·L-1的标准盐酸滴定一氢氧化钠溶液,再用此氢氧化钠溶液滴定未知浓度的盐酸,滴定时记录了以下2组数据:
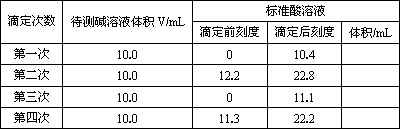
由以上数据算出碱液浓度为________mol·L-1,酸液浓度为________mol·L-1.
科目:高中化学 来源:黄冈重点作业 高三化学(下) 题型:038
| |||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:黄冈重点作业 高三化学(下) 题型:038
| |||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)M是什么金属?
(2)电解过程中,导线上流过的电子个数是多少?
(3)最初配制的溶液中,该金属离子物质的量浓度是多少?
(4)若此电解液在电解后体积为40 mL,此时溶液的pH是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下发生反应2A(g)=2B+C(g),将2 mol A通入2 L 容积恒定的密闭容器甲中,若维持容器内温度不变,5 min 末测得A的物质的量为0.8 mol 。用B的浓度变化来表示该反应的速率为
A.0.24 mo·min-1 B.0.08 mol·L-1·min-1
C.0.06 mol·L-1·min-1 D.0.12 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com