
 =0.2mol,
=0.2mol, MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O =4.48L,
=4.48L, MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O =0.8mol,
=0.8mol,

科目:高中化学 来源:高一化学 专题4 化学科学与人类文明 4.1 化学是认识和创造物质的科学(苏教版必修2) 苏教版 题型:022
氯气是一种重要的化工原料,历史上曾采用如下方法制备氯气,请回答相应的问题:
(1)1774年瑞典化学家舍勒用软锰矿(主要成分是MnO2)和浓盐酸作用最先制得了氯气,该反应的离子方程式为________.
(2)历史上曾用“地康法”制氯气.这一方法是用CuCl2作催化剂,在450℃利用空气中的氧气与氯化氢反应制氯气.这一反应的化学方程式为________.
(3)现代氯碱工业是化学工业的基础之一,是制氯气的重要方法.该反应的化学方程式为________.
查看答案和解析>>
科目:高中化学 来源:导学大课堂必修一化学人教版 人教版 题型:043
1774年,瑞典化学家舍勒发现氯气的同时也发现了氯水对纸张、蔬菜和花具有永久性的漂白作用.1785年法国化学家贝托雷(Claude Louis Berthollet)提出把漂白作用应用于生产,并注意到氯气溶于草木灰水形成的溶液比氯水更浓,漂白能力更强,而且不逸出氯气.1789年英国化学家台耐特(Smithson Tennant)把氯气溶解在石灰乳中,制成了漂白粉.
现在工业上还是采用把氯气通入消石灰或石灰乳的方法制取漂白粉.消石灰要含略少于1%(质量分数)的水,因为极为干燥的消石灰是不跟氯气反应的.生产漂白粉的反应过程比较复杂,主要反应可以表示如下:
2Cl2+3Ca(OH)2![]() Ca(ClO)2+CaCl2·Ca(OH)2·H2O+H2O
Ca(ClO)2+CaCl2·Ca(OH)2·H2O+H2O
在较高级的漂白粉中,氯化可按下面的化学方程式进行,反应比较安全.
2CaCl2·Ca(OH)2·H2O+2Cl2+8H2O![]() Ca(ClO)2+3CaCl2·4H2O
Ca(ClO)2+3CaCl2·4H2O
问题:
(1)漂白粉的成分是什么?漂白粉的有效成分是什么?
(2)用什么标准来衡量漂白粉的质量好坏呢?
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
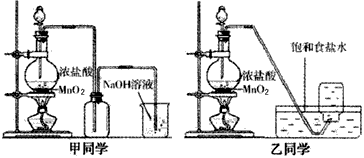

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com