
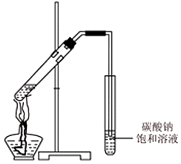
 ��֪���Ҵ���һ�ַdz���Ҫ���������������ɫ��������ζ��Һ�壮ij��ѧ��ȤС����Ҵ��Ľṹ�����ʽ���������̽����������벢��ɶ��й�����Ľ��
��֪���Ҵ���һ�ַdz���Ҫ���������������ɫ��������ζ��Һ�壮ij��ѧ��ȤС����Ҵ��Ľṹ�����ʽ���������̽����������벢��ɶ��й�����Ľ��| ʵ������ | �� �� | |
| �� | �Ƴ����Ҵ����� | �Ƶ��ܶȴ����Ҵ� |
���� ��1��������ԭ�ӵ�������ڷ����Ŀ��������֮�ȵ�����ԭ�ӵ���Ŀ֮�ȣ���ϵ�Ч���жϣ�
��2���Ҵ��к����ǻ�����������Ʒ�Ӧ�����������Ҵ����ܶȱ���С�������Ƴ����Ҵ��ײ�������ˮ�з�Ӧ�������������ң�������С�������������ݣ�
��3���Ҵ�������������ȩ����ȩ������������ͭ��Ӧ����ש��ɫ�������ݴ˼���ȩ����
��4�����ܲ��뵽����̼������Һ�л���������������ᡢ�Ҵ���Ũ���������·���������Ӧ������������������̼���ƿ������������������е����ᡢ�Ҵ���
��� �⣺��1���Ҵ��ṹ��ʽΪCH3CH2OH�������к���3����ԭ�ӣ��������������շ壬�����֮����1��2��3���ʴ�Ϊ��3��
��2���Ҵ��к����ǻ�����������Ʒ�Ӧ�����������Ҵ����ܶȱ���С�������Ƴ����Ҵ��ײ�������ˮ�з�Ӧ�������������ң�������С�������������ݣ�
�ʴ�Ϊ���������ݣ������Ҵ���Ӧ������������
��3���Ҵ�������������ȩ����Ӧ����ʽΪ��2 CH3CH2OH+O2 $��_{��}^{Cu}$2CH3CHO+2 H2O������������ͭ��Һ���ڼ��������·���������ԭ��Ӧ����ש��ɫ������
�ʴ�Ϊ��2 CH3CH2OH+O2$��_{��}^{Cu}$2CH3CHO+2 H2O�����Ƶ�������ͭ����Һ����ש��ɫ����������
��4���������ɵ����������л����Ҵ������ᣬ������ˮ������������������뱥��̼���Ƶĵ��ܲ�����Һ���£����ᡢ�Ҵ���Ũ���������·���������Ӧ����������������Ӧ�Ļ�ѧ����ʽΪCH3COOH+CH3CH2OH $?_{��}^{Ũ����}$CH3COOCH2CH3+H2O������̼���ƿ������������������е����ᡢ�Ҵ���
�ʴ�Ϊ�����ܲ��뵽����̼������Һ�У� CH3COOH+CH3CH2OH $?_{��}^{Ũ����}$CH3COOCH2CH3+H2O����ȥ���������е�������Ҵ���
���� �����ۺϿ����л���ṹʽ��ȷ���������Ҵ��ķ�Ӧ�������������Ʊ���֪ʶ��Ϊ�߿��������ͣ���Ŀ�Ѷ��еȣ������漰��֪ʶ��϶࣬ע�����ճ������ʵĽṹ�����ʣ���ȷ�˴Ź������ĺ��塢������Ӧԭ��Ϊ�����Ĺؼ���


 Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д� ���������������Բ��������ϵ�д�
���������������Բ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
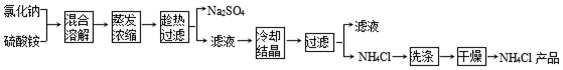
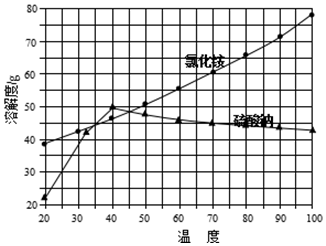
| �������� | ���� | ���� |
| ȡ�����Ȼ�鱗�Ʒ���Թܵײ������� | ����Թܵײ�û�й���ʣ�� | �����Ȼ�鱗�Ʒ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 500 mL��Һ�е���������������Ϊ0.3NA | |
| B�� | 500 mL��Һ��NO3-����Ũ��Ϊ0.2mol/L | |
| C�� | 500 mL��Һ��Ba2+����Ũ��Ϊ0.2mol/L | |
| D�� | 500 mL��Һ��NO3-��������Ϊ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
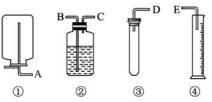 ��������ҩƷ��װ�ã�����Ϊw��w��1g����пƬ��ϡH2SO4����ˮ����ͭ������ˮ�����һ����ʵ�飬�ⶨZn�����ԭ���������������������Ϊ���ڱ�״���²ⶨ����ͼ
��������ҩƷ��װ�ã�����Ϊw��w��1g����пƬ��ϡH2SO4����ˮ����ͭ������ˮ�����һ����ʵ�飬�ⶨZn�����ԭ���������������������Ϊ���ڱ�״���²ⶨ����ͼ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com