
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
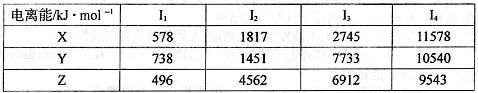
则X、Y、Z的电负性从大到小的顺序为___________ (用元素符号表示),元素Y的第一电离能大于X的第一电离能原因是__________________________________。
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化。
①A、B、C的第一电离能由小到大的顺序为_________________ (用元素符号表示)。
②M是含有______共价键的(填“极性”或“非极性” )
③W分子的VSEPR模型的空间构型为_________,W分子的空间构型为__________。
④AB-离子中和B2分子的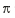 键数目比为_______________。
键数目比为_______________。
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1。
①F元素在其化合物中最高化合价为_____。
②G2+离子的核外电子排布式为__________。
(18分) (1)Al>Mg>Na ; 元素Mg价电子排布式为3s2,处于全充满状态,比Al的价电子排布3s23p1更稳定,则镁的第一电离能大于铝的第一电离能。
(2)① C<O<N ② 极性 ③V型 ④ 1:1 (3)① +6 ② [Ar]3d9
【解析】
试题分析:(1)根据电离能数据可知,X的第四电离能远大于第三电离能,所以X是第ⅢA族元素。题意分析可知Y是第ⅡA族元素,Z是第IA族元素,因此XYZ分别是Al、Mg、Na。金属性越强,电负性越小,所以X、Y、Z的电负性从大到小的顺序为Al>Mg>Na。由于元素Mg价电子排布式为3s2,处于全充满状态,比Al的价电子排布3s23p1更稳定,则镁的第一电离能大于铝的第一电离能。
(2)D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化。又因为均是前10号元素,所以D是H元素,A是碳元素,B是氮元素,C是氧元素。因此M是甲烷,N是氨气,W是水。
①非金属性越强,第一电离能越大,但 由于氮元素中2p轨道电子处于半充满状态,稳定性强,所以氮元素的第一电离能大于氧元素的第一电离能,因此A、B、C的第一电离能由小到大的顺序为C<O<N。
②甲烷是含有极性键的非极性分子。
③根据价层电子对互斥理论可知,水中中心原子含有的孤对电子对数是(6-2×1)÷2=2,所以水是V形结构。
④CN-和氮气中均含有三键,所以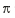 键数目比为1:1。
键数目比为1:1。
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1,所以EFG分别是K、Cr、Cu。
①Cr元素位于第ⅥB,在其化合物中最高化合价为+6价。
②根据工作原理可知,铜离子的核外电子排布式为[Ar]3d9。
考点:考查电负性、第一电离能大小比较,化学键、空间构型的判断以及化合价和核外电子排布的判断
点评:该题是高考中的常见题型,试题综合性强,难易适中,属于中等难度的试题。试题在注重对学生基础性知识巩固与训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和创新思维能力,也有利于培养学生的灵活应变能力,提高学生应试能力和学习效率。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
 下列是部分金属元素的电离能
下列是部分金属元素的电离能| X | Y | Z | |
| 第一电离能(kJ/mol) | 520.2 | 495.8 | 418.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
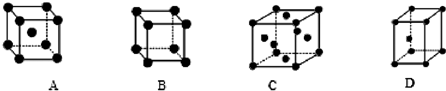
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2754 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| I4 | 9540 | 10540 | 11578 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)1、已知X、Y、Z、W为四种短周期主族元素,它们的原子序数依次增大,其中X、Y、W位于不同周期,Y是形成化合物种类最多的元素,Z可形成![]() 型化合物,常温下W的单质为气态。
型化合物,常温下W的单质为气态。
(1)由X、Y组成的最简单化合物可作为某燃料电池的 极反应物。
(2)化合物![]() 所含化学键种类为 ,属于 化合物(填“离子”或“共价”)。
所含化学键种类为 ,属于 化合物(填“离子”或“共价”)。
(3)写出实验室制备W单质的化学方程式为 。
Ⅱ、铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1) 黄铁矿( )是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
![]() ,有3mol
,有3mol![]() 参加反应,转移 mol电子。
参加反应,转移 mol电子。
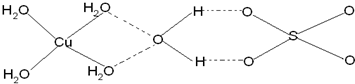
(2) 氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(3) 与明矾相似,硫酸铁也可用作净水剂,其原理是
(4)钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三第二次质量检测化学试卷 题型:填空题
(15分)1、已知X、Y、Z、W为四种短周期主族元素,它们的原子序数依次增大,其中X、Y、W位于不同周期,Y是形成化合物种类最多的元素,Z可形成 型化合物,常温下W的单质为气态。
型化合物,常温下W的单质为气态。
(1)由X、Y组成的最简单化合物可作为某燃料电池的 极反应物。
(2)化合物 所含化学键种类为 ,属于 化合物(填“离子”或“共价”)。
所含化学键种类为 ,属于 化合物(填“离子”或“共价”)。
(3)写出实验室制备W单质的化学方程式为 。
Ⅱ、铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)
黄铁矿( )是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
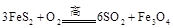 ,有3mol
,有3mol 参加反应,转移
mol电子。
参加反应,转移
mol电子。
氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(2) 与明矾相似,硫酸铁也可用作净水剂,其原理是 。
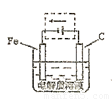
(4)钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com