
 ,
, .
.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| A、11.2L | B、5.6L |
| C、4.48L | D、2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
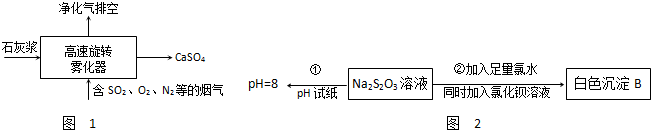
查看答案和解析>>
科目:高中化学 来源: 题型:
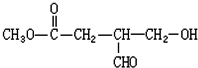
查看答案和解析>>
科目:高中化学 来源: 题型:
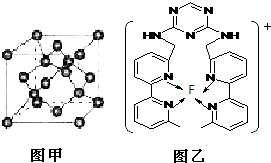
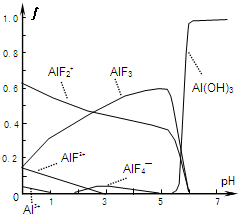 Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是
Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是| 温度/℃ | 1500 | 1800 | 2400 |
| 平衡常数K | 8.0×10-5 | 3.0×10-4 | 6.4×10-3 |
| 电离平衡常数 | |||
| 柠檬酸 | Ka1=7.1×10-4 | Ka2=1.68×10-5 | Ka3=4.1×10-7 |
| 氢氰酸 | Ka=4.93×10-10 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.A元素能级个数与核外电子数相等,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.A元素能级个数与核外电子数相等,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | Ka1 | Ka2 |
| H2C2O4 | 5.9×10-2 | 6.4×10-5 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
| H2SO3 | 1.3×10-2 | 5.6×10-8 |
| HClO | 4.7×10-10 | |
| CH3COOH | 1.6×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应中的能量变化通常表现为热量的变化 |
| B、化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C、反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
| D、需要加热才能发生的化学反应一定是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com