
【题目】常温下,用石墨电极电解100mL、0.1molL-1NH4Cl溶液,电解过程中溶液体积变化忽略不计,溶液的pH随阳极产生气体体积(标准状况下)变化的曲线如图,下列说法正确的是( )
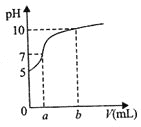
A.溶液pH=5时,c(NH3H2O)=1.0×10-5molL-1
B.电解过程使NH4+的水解程度减小,pH增大
C.若b=56mL,c(NH4+)≈5.01×10-2molL-1
D.若将阳极产生的bmL气体重新通回溶液,c(NH4+)不会改变
【答案】C
【解析】
用惰性材料作电极,电解NH4Cl溶液,根据电解原理,阳极反应式为2Cl--2e-=Cl2↑、2H2O-4e-=O2↑+4H+,阴极反应式为2H2O+2e-=H2↑+2OH-,据此分析;
A. 溶液的![]() 时,溶质只有NH4Cl,溶液中的
时,溶质只有NH4Cl,溶液中的![]() ,由于溶液中氢离子浓度包括水电离出的H+和NH4+水解产生的H+,则由
,由于溶液中氢离子浓度包括水电离出的H+和NH4+水解产生的H+,则由![]() ,可知
,可知![]() 略小于
略小于![]() ,故A说法错误;
,故A说法错误;
B. 由图可知,电解过程中,阴极是氢离子放电,使铵根离子的水解平衡正向移动,铵根离子的水解程度加大,故B说法错误;
C. 若氯气为56mL,则溶液中的![]() ,
,![]() ,由溶液中电荷守恒可知,
,由溶液中电荷守恒可知,![]() ,则
,则![]() ,故C说法正确;
,故C说法正确;
D. 电解过程中,阴极产生氢气,阳极产生氯气,若将阳极产生的bmL氯气重新通回溶液,溶液不能回复到原来的状态,![]() 会改变,故D说法错误。
会改变,故D说法错误。
答案:C。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】氮、磷、砷是原子序数依次增大的同一主族的三种元素,其化合物在工业农业中有重要用途。
(1)氮有多种重要的化合物。其中,N2O可用作发泡剂。
①NH3在加热和有催化剂的条件下,可以与O2反应生成N2O,该反应的化学方程式是_________。
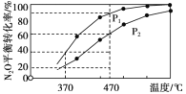
②在体积为1L的密闭容器中充入1mol N2O气体,发生反应2N2O(g) ![]() 2N2(g)+O2(g)。在不同温度下N2O的平衡转化率如下图所示。该反应的△H_________0(填“>”、“<”或“=” ),P1_______P2(填“大于”、“小于”或“等于”),370℃时,该反应的平衡常数K=_________。
2N2(g)+O2(g)。在不同温度下N2O的平衡转化率如下图所示。该反应的△H_________0(填“>”、“<”或“=” ),P1_______P2(填“大于”、“小于”或“等于”),370℃时,该反应的平衡常数K=_________。
(2)PH3和NH3与卤化氢的反应相似,产物的结构与性质也相似,下列对PH3与HCl反应产物的推断正确的是_________(选填字母序号)。
a.能与NaOH溶液反应 b.含有离子键与非极性共价键 c.水溶液显酸性
(3)三价砷有剧毒,五价砷毒性减弱。含As2O3的污水可被次氯酸钠碱性溶液转化为AsO43-而降低毒性。该反应的离子方程式是_________。
(4)HNO3、H3PO4、H3AsO4的酸性由强到弱的关系是________,请用原子结构理论解释原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图所示装置(夹持装置等已省略),其实验操作为:先按图安装好装置,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
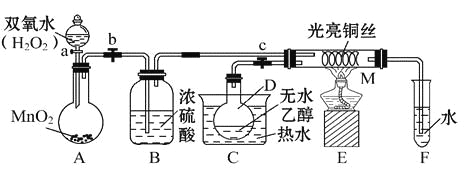
(1)A中发生反应的化学方程式:__________________,B的作用:_____________;C中热水的作用:_____________________。
(2)M处发生反应的化学方程式为_________________。
(3)从M管中可观察到的现象:_______________,从中可认识到该实验过程中催化剂______(填“参加”或“不参加”)化学反应,还可以认识到催化剂起催化作用需要一定的_____________。
(4)实验进行一段时间后,如果撤掉酒精灯,反应__________(填“能”或“不能”)继续进行,其原因是_____________。
(5)验证乙醇氧化产物的化学方法是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
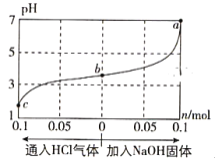
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2L甲烷、乙烷、甲醛组成的混合气体,完全燃烧后生成15.68L CO2(气体体积均在标准状况下测定),混合气体中乙烷的体积百分含量为( )
A.80%B.60%C.40%D.20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制480mL 0.1mol/L的CuCl2溶液,实际操作步骤有:
①在天平上称量一定量的CuCl2,放入烧杯,加水溶解;
②把制得的溶液小心地注入容量瓶中;
③继续向容量瓶中加水至距刻度1~2厘米处,改用胶头滴管加水至刻度;
④用少量水洗涤烧杯和玻璃棒2~3次,每次将洗涤液转入容量瓶,并摇匀;
⑤将容量瓶塞塞紧,充分摇匀。填写下列空白:
(1)称量CuCl2的总质量是______;
(2)操作步骤的正确顺序是(填序号)________;
(3)本实验使用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、______;
(4)若没有进行④操作,会使结果(填偏高、偏低或无影响,下同)_____;
(5)若用天平称固体时,砝码上沾有油污,则所配制的溶液浓度将_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同浓度的两种一元酸HX、HY分别用同一浓度的NaOH标准溶液滴定,滴定曲线如图所示。下列说法正确的是![]()
![]()
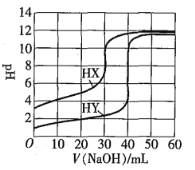
A.HX、HY起始溶液体积相同
B.均可用甲基橙作滴定指示剂
C.pH相同的两种酸溶液中:![]()
D.同浓度KX与HX的混合溶液中,粒子浓度间存在关系式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应xA(g)+yB(g)![]() zC(g)达平衡时,A的浓度为0.5mol/L。若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是( )
zC(g)达平衡时,A的浓度为0.5mol/L。若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是( )
A.x+y<zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com