
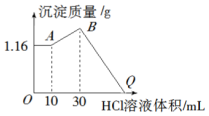
 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示.分析 向水中固体组成的混合物溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2;
A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,B点溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3;B-Q过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以Q点溶液中的溶质是氯化铝、氯化镁和氯化钠,
(1)向水中固体组成的混合物溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子.镁离子全部反应生成氢氧化镁沉淀;
(2)分析可知,B点溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3;
(3)A点沉淀的是氢氧化镁,则n(Mg(OH)2)=$\frac{1.16g}{58g/mol}$=0.02mol,根据Mg原子守恒得n(MgCl2)=n(Mg(OH)2)=0.02mol,氯化镁的质量为:0.02mol×95g/mol=1.90g,A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol,根据铝原子守恒得n(AlCl3)=n(AlO2-)=0.02mol;由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)计算得到氢氧化钠物质的量计算得到氢氧化钠的质量;
(4)B-Q过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以Q点溶液中的溶质是氯化铝、氯化镁和氯化钠,实际上相当于氢氧化钠和盐酸的反应,所以二者恰好反应时:n(NaOH)=n(HCl),据此进行分析.
解答 解:(1)向水中固体组成的混合物溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O,
故答案为:Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O;
(2)A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,B点溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3,
故答案为:Mg(OH)2、Al(OH)3;
(3)A点沉淀的是氢氧化镁,则n(Mg(OH)2)=$\frac{1.16g}{58g/mol}$=0.02mol,根据Mg原子守恒得n(MgCl2)=n(Mg(OH)2)=0.02mol,氯化镁的质量为:0.02mol×95g/mol=1.90g;A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol,根据铝原子守恒得n(AlCl3)=n(AlO2-)=0.02mol,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3+0.03L×1mol/L=0.13mol,氢氧化钠的质量为:0.13mol×40g/mol=5.20g
故答案为:0.02mol;5.20g;
(4)B-Q过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以Q点溶液中的溶质是氯化铝、氯化镁和氯化钠,实际上相当于氢氧化钠和盐酸的反应,所以二者恰好反应时:n(NaOH)=n(HCl),则V(HCl)=$\frac{0.13mol}{1mol/L}$═0.13L=130mL,
故答案为:130ml.
点评 本题考查了混合物反应的计算,题目难度中等,明确曲线变化趋势及每段发生的化学反应为解本题关键,注意掌握质量守恒定律在化学计算中的应用,试题培养了学生达到分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
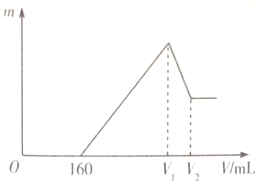 将0.1mol的Mg、Al混合物溶于100mL2mo L•L-1稀硫酸中,然后再滴加1moL•L-1 NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(随加入NaOH溶液的体积(V)变化如图所示,当开始出现沉淀(不考虑混合时溶液体积的变化)下列判断正确的是( )
将0.1mol的Mg、Al混合物溶于100mL2mo L•L-1稀硫酸中,然后再滴加1moL•L-1 NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(随加入NaOH溶液的体积(V)变化如图所示,当开始出现沉淀(不考虑混合时溶液体积的变化)下列判断正确的是( )| A. | Mg与Al的质量比为3:2 | B. | (V1-160):(V2-V1)=3:1 | ||
| C. | 沉淀质量m最大=3.48 g | D. | V1时:c(Na+)=$\frac{400}{100+{V}_{1}}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 变深 | B. | 变浅 | C. | 变黄 | D. | 不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
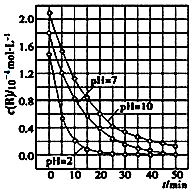 二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )
二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )| A. | 在0~50 min之间,R的降解百分率pH=2大于pH=7 | |
| B. | 溶液酸性越强,R的降解速率越大 | |
| C. | R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响 | |
| D. | 在20~25 min之间,pH=10时R的降解速率为04mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2S未溶解完 | |
| B. | 硝酸恰好完全反应 | |
| C. | 实际参加反应的Cu2S与HNO3的物质的量之比为1:7 | |
| D. | 反应的Cu2S与被还原的HNO3的物质的量之比为3:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
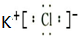 ;
;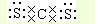 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com