
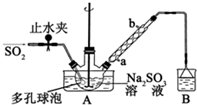
 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:分析 (1)装置B吸收未反应的二氧化硫等;采取逆流原理通入冷凝水;
(2)多孔球泡可以增大气体与液体的接触面积;
(3)步骤2中锌粉和甲醛溶液、NaHSO3溶液发生氧化还原反应生成次硫酸氢钠甲醛和氢氧化锌沉淀;
(4)次硫酸氢钠甲醛具有强还原性,遇到空气中的氧气易被氧化;
(5)①洗涤不干净,会附着氯化钡,检验最后一次洗涤液是否含有氯离子判断;
②由NaHSO2•HCHO•2H2O+2I2=NaHSO4+HI+HCHO、NaHSO4+BaCl2=BaSO4↓+HCl+NaCl,可得关系式:NaHSO2•HCHO•2H2O~BaCl2,根据关系式计算.
解答 解:(1)装置B吸收未反应的二氧化硫等,可以用氢氧化钠溶液吸收;采取逆流原理通入冷凝水,可以充分冷却,即从a口中通入冷凝水,
故答案为:氢氧化钠溶液;a;
(2)多孔球泡可以增大气体与液体的接触面积,加快气体的吸收速率,
故答案为:增大气体与溶液的接触面积,加快气体的吸收速率;
(3)步骤2中锌粉和甲醛溶液、NaHSO3溶液发生氧化还原反应生成次硫酸氢钠甲醛和氢氧化锌沉淀,反应方程式为NaHSO3+HCHO+Zn+H2O=NaHSO2•HCHO+Zn(OH)2,
故答案为:NaHSO3+HCHO+Zn+H2O=NaHSO2•HCHO+Zn(OH)2;
(4)次硫酸氢钠甲醛具有强还原性,遇到空气中的氧气易被氧化,所以步骤3中在真空容器中蒸发浓缩的原因是防止温度过高使产物分解,也防止氧气将产物氧化,
故答案为:防止氧气将产物氧化;
(5)①洗涤不干净,会附着氯化钡,检验沉淀是否洗净方法:取最后一次洗涤液少许于试管中,滴加HNO3酸化的AgNO3溶液,若无白色沉淀,说明已经洗净,若有白色沉淀,则未洗净,
故答案为:取最后一次洗涤液少许于试管中,滴加HNO3酸化的AgNO3溶液,若无白色沉淀,说明已经洗净,若有白色沉淀,则未洗净;
②由NaHSO2•HCHO•2H2O+2I2=NaHSO4+HI+HCHO、NaHSO4+BaCl2=BaSO4↓+HCl+NaCl,可得关系式:NaHSO2•HCHO•2H2O~BaCl2,硫酸钡的质量为0.466g,其物质的量为$\frac{0.466g}{233g/mol}$=0.002mol,所以样品中纯NaHSO2•HCHO•2H2O的质量为0.002mol×$\frac{100mL}{20mL}$×154g/mol=1.54g,所以纯度=$\frac{1.54g}{2g}$×100%=77%,
故答案为:77%.
点评 本题考查物质制备实验,涉及对原理与操作的分析评价、对装置的分析评价、仪器的使用、实验方案设计、物质含量测定等,题目比较综合,是对学生综合能力的考查,难度中等.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
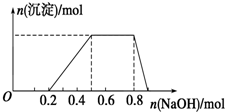 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )| A. | 该溶液中肯定含有的离子是H+、NH4+、Al3+、SO42- | |
| B. | 肯定不含的阳离子是Mg2+、Fe3+ | |
| C. | 要确定该溶液是否含有Na+,必须做焰色反应实验,看焰色是否为黄色 | |
| D. | 该溶液中肯定含有的离子的物质的量之比为n(H+):n(NH4+):n(Al3+):n(SO42-)=2:3:1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硝酸、浓硫酸均能将木炭氧化成二氧化碳 | |
| B. | Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱 | |
| C. | Li、C、S分别在足量氧气中燃烧均生成一种相应氧化物 | |
| D. | NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
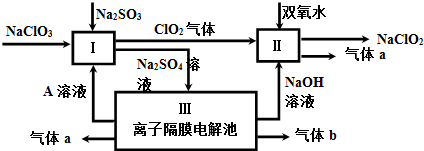
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
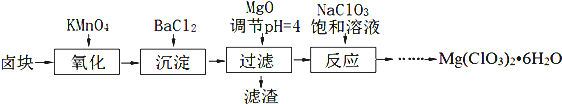
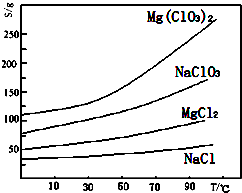
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③④ | C. | ①②④ | D. | ①②④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
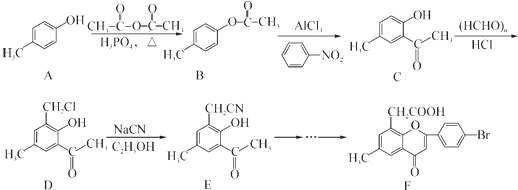
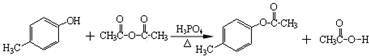 .
.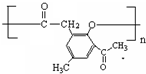 .
.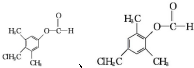 .
.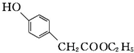 )是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
)是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下: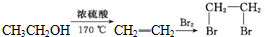
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com