
【题目】碳的氧化物对环境的影响较大,研究和开发碳的氧化物的应用对发展低碳经济,构建生态文明社会具有重要的意义。
(1)已知:①甲醇的燃烧热ΔH=-726.4 kJ·mol-1;
②H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则二氧化碳和氢气合成液态甲醇、生成气态水的热化学方程式为_____________。
(2)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g)CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与![]() 的关系如图所示:
的关系如图所示:
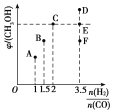
①当起始![]() =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=______。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4mol,达到新平衡时H2的转化率将________(填“增大”“减小”或“不变”)。
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=______。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4mol,达到新平衡时H2的转化率将________(填“增大”“减小”或“不变”)。
②当![]() =3.5时,达到平衡后,CH3OH的体积分数可能是图像中的________(填“D”“E”或“F”)点。
=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的________(填“D”“E”或“F”)点。
(3)已知由CO2生成CO的化学方程式为CO2(g)+O(g)CO(g)+O2(g),其正反应速率为v正=k正·c(CO2)·c(O),逆反应速率为v逆=k逆·c(CO)·c(O2),k为速率常数。2500 K时,k逆=1.21×105L·s-1·mol-1,k正=3.02×105L·s-1·mol-1,则该温度下该反应的平衡常数K为________。(保留小数点后一位小数)
(4)CH3OH—O2在新型聚合物催化下可发生原电池反应,其装置如图:
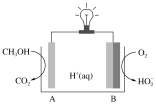
①外电路中每转移3mol电子,溶液中生成_______molH+
②写出电极B的电极反应式:__________。
【答案】CO2(g)+3H2(g)=CH3OH(l)+H2O(g) ΔH=-87.0 kJ·mol-1 0.12 mol·L-1·min-1 增大 F 2.5 3 O2+2e-+H+=![]()
【解析】
(1)根据盖斯定律分析;
(2)①根据CO和H2的总量以及二者的比例计算CO与氢气各自的物质的量,利用三段式计算平衡时各组分物质的量、各组分物质的量变化量,根据![]() 计算反应速率;先计算该温度下平衡常数K,再计算浓度商Qc,与平衡常数K相比判断反应进行分析,可以确定氢气转化率变化;
计算反应速率;先计算该温度下平衡常数K,再计算浓度商Qc,与平衡常数K相比判断反应进行分析,可以确定氢气转化率变化;
(3)根据平衡时正逆反应速率相等确定速率常数和平衡常数的关系;
(4)根据图示该电池放电时CH3OH转化为CO2,碳元素化合价升高被氧化,所以A电极为负极,O2转化为HO![]() ,氧元素化合价降低被还原,所以B为电池的正极。
,氧元素化合价降低被还原,所以B为电池的正极。
(1)甲醇的燃烧热化学方程式为①CH3OH(l)+![]() O2(g)=2H2O(l)+CO2(g) ΔH=-726.4 kJ·mol-1;
O2(g)=2H2O(l)+CO2(g) ΔH=-726.4 kJ·mol-1;
又已知②H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1;
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1;
③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1;
二氧化碳和氢气合成液态甲醇、生成气态水的热化学方程式为:CO2(g)+3H2(g)=CH3OH(l)+H2O(g),根据盖斯定律②×3-①-③得ΔH=(-285.8 kJ·mol-1)×3-(-726.4 kJ·mol-1)-(-44 kJ·mol-1)=-87 kJ·mol-1;则热化学方程式为CO2(g)+3H2(g)=CH3OH(l)+H2O(g) ΔH=-87 kJ·mol-1;
(2)①![]() =2,二者物质的量之和为3mol,所以n(H2)=2mol,n(CO)=1mol。平衡时CO的转化率为0.6,则列三段式为:
=2,二者物质的量之和为3mol,所以n(H2)=2mol,n(CO)=1mol。平衡时CO的转化率为0.6,则列三段式为:
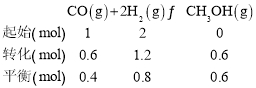
所以0~5mi内,Δn(H2)=1.2mol,容器体积为2L,所以v(H2)=![]() =0.12mol·L-1·min-1;
=0.12mol·L-1·min-1;
容器体积为2L,结合三段式可知平衡时c(H2)=0.4mol/L,c(CO)=0.2mol/L,c(CH3OH)=0.3mol/L,所以该温度下平衡常数K=![]() ,再向容器中加入CO(g)和CH3OH(g)各0.4mol,则此时c(CO)=0.4mol/L,c(CH3OH)=0.5mol/L,浓度商为
,再向容器中加入CO(g)和CH3OH(g)各0.4mol,则此时c(CO)=0.4mol/L,c(CH3OH)=0.5mol/L,浓度商为![]() <9.375,所以平衡会正向移动,氢气的转化率增大;
<9.375,所以平衡会正向移动,氢气的转化率增大;
②对于可逆反应,当反应物的投料比等于计量数之比时,产物的占比最大,所以当![]() =2时,甲醇的体积分数最大,所以
=2时,甲醇的体积分数最大,所以![]() =3.5时,平衡时甲醇的体积分数可能为图中F点;
=3.5时,平衡时甲醇的体积分数可能为图中F点;
(3)反应平衡正逆反应速率相等,即v正=k正·c/span>(CO2)·c(O)=v逆=k逆·c(CO)·c(O2),此时![]() ,而该反应的平衡常数K=
,而该反应的平衡常数K=![]() =
=![]() =
=![]() ≈2.5;
≈2.5;
(4)①电解质溶液为酸性溶液,结合分析,A极的电极反应为CH3OH-6e-+H2O=CO2+6H+,B极的电极反应式为O2+2e-+H+=![]() ;根据电子守恒可知外电路中每转移3mol电子,溶液中生成3molH+;
;根据电子守恒可知外电路中每转移3mol电子,溶液中生成3molH+;
②B极为正极,得电子发生还原反应,电极反应式为O2+2e-+H+=![]() 。
。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中都有非常重要的作用。下表(元素周期表前三周期的一部分)列出了①~⑦七种元素在周期表中的位置。
① | ② | ③ | |||
④ | ⑤ | ⑥ | ⑦ |
请回答:
(1)②所代表元素的名称为______
(2)七种元素中,非金属性最强的元素是______(填元素符号),最高价氧化物的水化物酸性最强的是_______(填化学式),最高正化合价与最低负化合价的代数和为4的元素是_______(填元素符号)。
(3)②、④、⑥所对应元素中原子半径最小的是______(填元素符号),简单离子半径最大的是______(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活中有广泛应用。
(1)![]() 可用作净水剂,也可用于无线电印刷电路做蚀刻剂。某化学兴趣小组利用如图所示装置向
可用作净水剂,也可用于无线电印刷电路做蚀刻剂。某化学兴趣小组利用如图所示装置向![]() 的铁屑中通入
的铁屑中通入![]() 生产无水
生产无水![]() 。已知:
。已知:![]() 固体呈黑棕色、易潮解、
固体呈黑棕色、易潮解、![]() 左右时升华。
左右时升华。
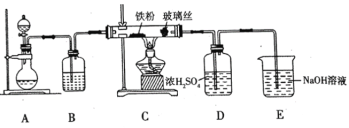
回答下列问题
①写出用高锰酸钾和浓盐酸在装置![]() 中制备氯气的离子方程式_____。
中制备氯气的离子方程式_____。
②装置![]() 中加入的试剂是_____,装置
中加入的试剂是_____,装置![]() 中玻璃丝的作用是_____,
中玻璃丝的作用是_____,![]() 中
中![]() 溶液的作用是_____。
溶液的作用是_____。
③有同学认为气体通入装置![]() 前应除去其中含有的
前应除去其中含有的![]() ,改进措施为_____。
,改进措施为_____。
(2)一种新型高效净水剂![]() (聚合氯化铁铝
(聚合氯化铁铝![]() ,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取
,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取![]() ,设计生产流程如下:
,设计生产流程如下:
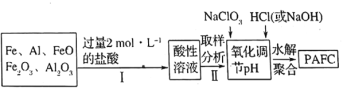
①实验室现需用![]() 的稀盐酸,欲用
的稀盐酸,欲用![]() 的浓盐酸配制,则所需浓盐酸体积为________。
的浓盐酸配制,则所需浓盐酸体积为________。
②![]() 中
中![]() 显________价,
显________价,![]() 在强酸性和强碱性溶液中均________稳定存在(填“能”或“不能”)。
在强酸性和强碱性溶液中均________稳定存在(填“能”或“不能”)。
③步骤Ⅱ中取样分析的目的是________。
A.测定溶液中![]() 与
与![]() 的含量比 B.测定原料是否完全溶解
的含量比 B.测定原料是否完全溶解
C.测定溶液中![]() 的含量,以确定加入
的含量,以确定加入![]() 的量 D.测定溶液中
的量 D.测定溶液中![]() 的含量
的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 2H2S+SO2=3S↓+2H2O中,氧化产物和还原产物物质的量之比为2:1
B. 4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O中,氧化剂和还原剂物质的量之比为5:2
C. 3I2+6KOH![]() 5KI+KIO3+3H2O中,被氧化和被还原的碘原子物质的量之比为1:5
5KI+KIO3+3H2O中,被氧化和被还原的碘原子物质的量之比为1:5
D. 2FeS+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+2S↓+6H2O中,发生氧化反应和发生还原反应的硫原子物质的量之比为2:3
Fe2(SO4)3+3SO2↑+2S↓+6H2O中,发生氧化反应和发生还原反应的硫原子物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)![]() 2CO2(g)+S(s)
2CO2(g)+S(s)
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,若升高温度,CO体积分数增大,则该反应的△H>0
D. 其他条件不变,增大压强,该反应平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K,1.01×105Pa条件下:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1;
CO(g)+![]() O2(g)=CO2(g) △H=-282.9kJ·mol-1则该条件下CO(g)+H2O(g) = H2(g)+CO2(g)的反应热是
O2(g)=CO2(g) △H=-282.9kJ·mol-1则该条件下CO(g)+H2O(g) = H2(g)+CO2(g)的反应热是
A. - 41.1 kJ·mol-1B. + 200.7 kJ·mol-1
C. - 766.5 kJ·mol-1D. + 41.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
A.v(A)=0.5 mol·L1·min 1B.v(B)=0.1 mol·L1·s1
C.v(C)=0.8 mol·L1·min 1D.v(D)=1 mol·L1·min 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。结合氯气的物理性质,判断下列叙述中不正确是________________(填序号)。
MnCl2+Cl2↑+2H2O。结合氯气的物理性质,判断下列叙述中不正确是________________(填序号)。
①加热盛有二氧化锰、浓盐酸的烧瓶,瓶内充满黄绿色气体。
②氯气的密度比空气大,常用向上排空气法收集氯气。
③闻氯气气味时,用手轻轻在集气瓶口扇动,使极少量氯气飘进鼻孔。
④在充满氯气的集气瓶内加水,盖严后振荡,瓶内气体颜色变浅,液体变为黄绿色。
⑤氯气易液化,在低温和加压的条件下可以转变为液态(液氯)和固态。
⑥氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼及其化合物正越来越多的受到人们的关注 ,其中钼酸钠(Na2MoO4)可溶于水,是一种重要的金属缓蚀剂;钼酸钙(CaMoO4)微溶于水,常用作钼合金添加剂;钼酸属于弱酸,微溶于水,常用于制取高纯同多酸盐。工业上利用辉钼矿(主要成分为MoS2)制备金属钼和钼酸钠晶体的流程如图所示。
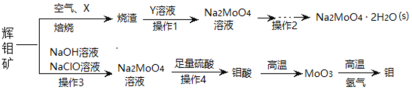
回答下列问题:
(1)辉钼矿在空气中焙烧时,加入X是为了减少空气污染,焙烧后Mo元素以CaMoO4存在,则X是________;焙烧时发生反应的化学方程式为__________。
(2)已知25℃时,钼酸钙的Ksp=1.6×10-5,则钼酸钙在该温度下的溶解度为_______g/100g水,但钼酸钙实际溶解度比计算值大许多,其原因是_______,操作2中得到的钼酸钠晶体中常混有Y,进一步提纯钼酸钠晶体的方法为__________。
(3)辉钼矿中MoS2含量测定:取辉钼矿0.2500g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体0.1210g(Mr=242g/mol),辉钼矿中MoS2的质量分数不低于______%。
(4)操作3发生反应的离子方程式为_________________。
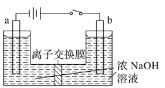
(5)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如下图所示。b电极的材料为______(填“镍”或“钼”),电极反应为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com