
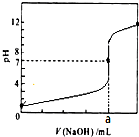
 常温下,用0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LHCl溶液,滴定曲线,如图所示.下列说法不正确的是( )
常温下,用0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LHCl溶液,滴定曲线,如图所示.下列说法不正确的是( )| A. | a=20.00 | |
| B. | 滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-) | |
| C. | 若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 | |
| D. | 若将盐酸换成同浓度的醋酸,则滴定到pH=7时,a<20.00 |
分析 A、根据NaOH和HCl恰好反应时生成强酸强碱盐,溶液呈中性;
B、根据滴定过程酸过量来分析,少量氢氧溶液滴入盐酸溶液中,HCl多,溶液中可以存在c(Cl-)>c(H+)>c(Na+)>c(OH-);
C、氢氧化钠是强碱溶液,滴定盐酸溶液,属于强碱滴定强酸溶液,恰好反应后生成氯化钠溶液呈中性,根据滴定终点的判断方法,选择酚酞做指示剂滴入最后一滴无色变化为为浅红色且半分钟不变说明反应达到终点;
D、NaOH和醋酸恰好反应时生成强碱弱酸盐,溶液呈碱性,若要呈中性,则醋酸过量.
解答 解:A、NaOH和HCl恰好反应时,消耗20mlNaOH溶液,生成强酸强碱盐,溶液呈中性,故A正确;
B、滴定过程酸过量时,溶液中存在HCl和少量NaCl,溶液中的离子浓度大小可以为:c(Cl-)>c(H+)>c(Na+)>c(OH-),故B正确;
C、氢氧化钠是强碱溶液,滴定盐酸溶液,属于强碱滴定强酸溶液,恰好反应后生成氯化钠溶液呈中性,用酚酞作指示剂进行中和滴定时,当溶液由无色变为红色时,且30秒内不褪色,说明反应达到终点停止滴定,故C错误;
D、NaOH和醋酸恰好反应时,即a=20.00时,生成强碱弱酸盐,溶液呈碱性,若要滴定到pH=7时,酸应过量,则a<20.00,故D正确;
故选C.
点评 本题考查了常见的实验操作,注意过程的分析,难度不大,应注意相关知识的积累.


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
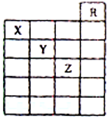 如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )| A. | 只有①③ | B. | 只有①④ | C. | 只有①②③④ | D. | 全部都是 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
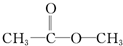
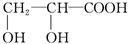 乙:
乙: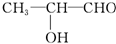
 丁:
丁: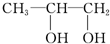
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
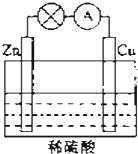 电能是现代社会应用最广泛的能源之一.如图所示的原电池装置中,其负极是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑.原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.
电能是现代社会应用最广泛的能源之一.如图所示的原电池装置中,其负极是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑.原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
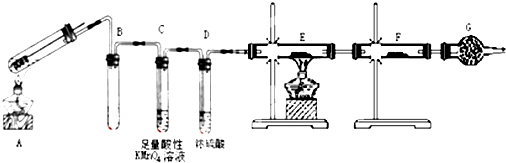
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,质量为32gO2含有的原子数为2NA | |
| B. | 2L0.1mol/LNaCl溶液中含有NaCl分子数为0.2NA | |
| C. | 78gNa2O2与足量CO2完全反应吗,转移的电子数为2NA | |
| D. | 在25℃,101Pa条件下,11.2L氯气所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物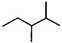 按系统命名法的名称为2,3一二甲基丁烷 按系统命名法的名称为2,3一二甲基丁烷 | |
| B. | 淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体 | |
| C. | 等质量的聚乙烯、甲烷、乙烯分别充分燃烧,所耗氧气的量依次减少 | |
| D. | 通常用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
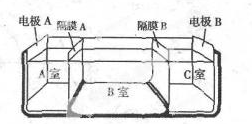 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com