


科目:高中化学 来源:不详 题型:实验题
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取反应后的固体放入试管中,…… | |

| SO2被氧化的程度 | V与m1或m2的关系 |
| 完全被氧化 | V=0 |
| 部分被氧化 | |
| 未被氧化 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
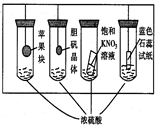
| A.苹果块会干瘪 |
| B.胆矾晶体表面有“白斑” |
| C.小试管内有KNO3晶体析出 |
| D.蓝色石蕊试纸变红 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.吸水性和酸性 | B.脱水性和吸水性 |
| C.强氧化性和吸水性 | D.不挥发性和酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2SO4
H2SO4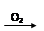 SO2
SO2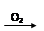 SO3
SO3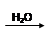 H2SO4
H2SO4| A.途径①反应中体现了浓HNO3的强氧化性和酸性 |
| B.途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本 |
| C.由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e- |
| D.途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
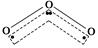
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com