D
分析:A、质量换算物质的量,结合构成硫酸氢钠晶体的微粒是钠离子和硫酸氢根离子计算判断;
B、浓硫酸与铜反应,随着反应进行浓度变稀,稀硫酸不与铜反应;
C、碳酸根离子水解阴离子增多;
D、乙烯和丙烯最简式相同,质量换算物质的量,计算42gCH
2中的碳原子数即可;
解答:A、1.2 g NaHSO
4晶体物质的量=
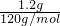
=0.01mol,硫酸氢钠晶体的微粒是钠离子和硫酸氢根离子构成,阳离子和阴离子的总数为0.02 N
A,故A错误;
B、浓硫酸与铜反应,随着反应进行浓度变稀,稀硫酸不与铜反应,生成SO
2的分子数小于0.92 N
A,故B错误;
C、碳酸根离子水解CO
32-+H
2O?HCO
3-+OH
-;阴离子数增多,所以1 L 1 mol?L
-1的K
2CO
3溶液中离子总数大于3N
A,故C错误;
D、乙烯和丙烯最简式相同,质量换算物质的量,计算42gCH
2中的碳原子数即可;含有的碳原子数=

=3mol,即为3N
A,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,主要考查质量换算物质的量计算微粒数,盐类水解的应用,关键是浓硫酸随反应进行浓度减小为稀硫酸后不再与铜反应.

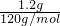 =0.01mol,硫酸氢钠晶体的微粒是钠离子和硫酸氢根离子构成,阳离子和阴离子的总数为0.02 NA,故A错误;
=0.01mol,硫酸氢钠晶体的微粒是钠离子和硫酸氢根离子构成,阳离子和阴离子的总数为0.02 NA,故A错误; =3mol,即为3NA,故D正确;
=3mol,即为3NA,故D正确;

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案