
【题目】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、![]() 和
和![]() 的物种分布分数α(X)=
的物种分布分数α(X)=![]() 与pH的关系如图所示:
与pH的关系如图所示:
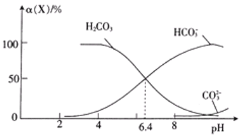
下列说法正确的是
A.![]() H++
H++![]() 的lgK=-6.4
的lgK=-6.4
B.pH=8的溶液中:c(Na+)>c(![]() )
)
C.NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)=c(Cl-)
D.向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:![]() +OH-=
+OH-=![]() +H2O
+H2O
【答案】B
【解析】
A.根据图像,当pH═6.4时,c(![]() )═c(H2CO3),则H2CO3H++
)═c(H2CO3),则H2CO3H++![]() 的K=
的K=![]() =10-6.4,lgK═lg10-6.4=-6.4,H2CO3的一级电离远大于二级电离,则
=10-6.4,lgK═lg10-6.4=-6.4,H2CO3的一级电离远大于二级电离,则![]() H++
H++![]() 的lgK<-6.4,故A项错误;
的lgK<-6.4,故A项错误;
B.pH═8的溶液中:c(H+)<c(OH-),溶液中电荷守恒为c(Na+)+c(H+)═c(![]() )+2c(
)+2c(![]() )+c(OH-),所以c(Na+)>c(
)+c(OH-),所以c(Na+)>c(![]() )+2c(
)+2c(![]() ),则c(Na+)>c(
),则c(Na+)>c(![]() ),故B项正确;
),故B项正确;
C.向NaHCO3溶液中滴入少量盐酸至溶液显中性时,溶液中c(H+)=c(OH-),溶液中电荷守恒为c(Na+)+c(H+)═c(![]() )+2c(
)+2c(![]() )+c(OH-)+c(Cl-),则c(Na+)═c(
)+c(OH-)+c(Cl-),则c(Na+)═c(![]() )+2c(
)+2c(![]() )+c(Cl-),故C项错误;
)+c(Cl-),故C项错误;
D.由图像可知,向pH=6.4的溶液中滴加NaOH溶液至pH=8,随着溶液pH的增大,溶液中H2CO3减小,![]() 增多,主要发生的离子反应为H2CO3+OH-=
增多,主要发生的离子反应为H2CO3+OH-=![]() +H2O,故D项错误;
+H2O,故D项错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是以乙炔(结构简式为![]() )为主要原料合成聚氯乙烯、聚丙烯腈和氯丁橡胶的转化关系图。
)为主要原料合成聚氯乙烯、聚丙烯腈和氯丁橡胶的转化关系图。
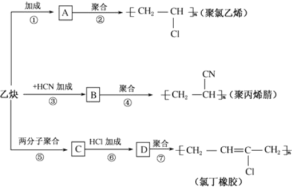
(1)写出A、B、C、D四种物质的结构简式:
A:________,B:________,C:________,D:________。
(2)写出有关反应的化学方程式:
②:____________;
③:_____________;
⑤:___________;
⑦:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。总反应为CO(NH2)2+H2O=3H2↑+N2↑+CO2↑。下列说法中错误的是

A. a为阳极,CO(NH2)2发生氧化反应
B. b电极反应为:2H2O+2e-=H2↑+2OH-
C. 每转移6mol电子,a电极产生1molN2
D. 电解一段时间,a极区溶液pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B.![]() C. c(H+)c(OH﹣) D.
C. c(H+)c(OH﹣) D. ![]() E.
E. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )
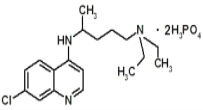
A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组所做实验的示意图如图所示:图中“→”表示气体流向, M是一种纯净而干燥的气体,Y为另一种气体,E内有红棕色气体产生,实验所用物质只能由下列物质中选取:Na2CO3、Na2O2、NaCl、Na2O、CaCl2、(NH4)2CO3、碱石灰等固体及蒸馏水。据此实验,完成下列填空:
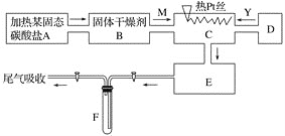
(1)A中所用装置的主要仪器和药品是______________________。
(2)B中所选的干燥剂是________,其作用是______________________________。
(3)C中发生的主要反应的化学方程式:________________________________。
(4)制取Y气体的D装置所用的主要仪器是__________________________。
制取Y气体的化学方程式是________________________。
(5)F中发生反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示.下列说法正确的是( )
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下,此反应的平衡常数K=6.75
B.若升高温度,W的体积分数减小,则此反应△H>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,此反应的平衡常数表达式是 K= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种常用燃料(1mol)完全燃烧时放出的热量:
物质 | 炭粉(C) | 一氧化碳(CO) | 氢气(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1367 |
(1)从热量角度分析,目前最适合家庭使用的优质气体燃料是___。
(2)写出管道煤气中的一氧化碳燃烧的热化学方程式___。
(3)充分燃烧1mol表中各种燃料,排放出二氧化碳的量最多的是___。
(4)矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有氢能、___等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20mL0.1mol·L-1一元弱酸HA溶液中滴加0.1mol·L-1NaOH溶液,溶液中1g![]() 与pH关系如图所示。下列说法不正确的是
与pH关系如图所示。下列说法不正确的是
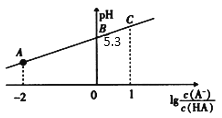
A.A点对应溶液中:c(A-)>c(Na+)>c(H+)>c(OH-)
B.25℃时,HA酸的电离常数的数量级为 10-6
C.对C点溶液加水稀释,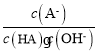 一定减小
一定减小
D.当加入NaOH溶液体积为10 mL时,水的电离受到了抑制
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com