
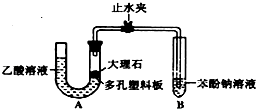
 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.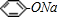 溶液
溶液分析 (1)根据体系内产生的压强是否变化来判断装置的气密性,碳酸钙和醋酸反应生成醋酸钙和水、二氧化碳;
(2)二氧化碳和苯酚钠反应生成不易溶于水的苯酚和碳酸氢钠,根据离子方程式的书写规则书写;
(3)要防止醋酸干扰实验,在气态未和苯酚反应前将其除去,可选用饱和的碳酸氢钠溶液除去醋酸且又不引进新的杂质气体;
(4)证明乙酸为弱酸需证明溶液中存在电离平衡,依据提供的试剂可以对溶液稀释测定溶液PH的变化分析判断是否存在电离平衡分析设计;
(5)都根据盐类水解规律,越弱越水解,对应的酸越弱,水解程度越大,溶液的pH越大进行判断各溶液的pH大小.
解答 解:(1)左管液面高于右管液面,静置一段时间后,若U型管两侧液面差不发生变化,说明装置气密性良好,所以该生的操作正确;碳酸钙和醋酸反应生成醋酸钙和水、二氧化碳,反应方程式为CaCO3+2CH3COOH=Ca(CH3COO)2+CO2↑+H2O,
故答案为:正确;CaCO3+2CH3COOH=Ca(CH3COO)2+CO2↑+H2O;
(2)装置A中反应产生的气体为CO2,通入苯酚钠溶液中,生成常温下溶解度较小的苯酚,所以实验现象为:试管中溶液出现浑浊,反应离子方程式为:C6H5O-+CO2+H2O→C6H5OH+HCO3-,
故答案为:试管中溶液出现浑浊;C6H5O-+CO2+H2O→C6H5OH+HCO3-;
(3)为防止挥发出的乙酸与苯酚钠反应,所以应在在装置A和B之间连一个吸收乙酸的装置,所以改进该装置的方法是:在装置A和B之间连一个盛有饱和碳酸氢钠溶液的洗气瓶,
故答案为:在装置A和B之间连一个盛有饱和氢钠溶液的洗气瓶;
(4)强酸溶液完全电离,弱酸溶液存在电离平衡,加水稀释,电离平衡向右移动,所以证明乙酸为弱酸的最简便的使用方法为:用量筒量取一定体积的乙酸溶液,加蒸馏水稀释100倍,用pH试纸测其pH,pH<5,则证明乙酸是弱酸,
故答案为:用量筒量取一定体积的乙酸溶液,加蒸馏水稀释100倍,用pH试纸测其pH,pH<5,则证明乙酸是弱酸(或其他合理答案);
(5)a.NaHCO3溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.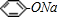 ,以上都是强碱弱酸盐,溶液都显示碱性,化学式中含有的弱酸根离子对应的酸的酸性越强,其水解程度越弱,溶液的pH越小,而酸性关系为:醋酸>碳酸>苯酚>碳酸氢根离子,则以上溶液的pH由大到小排列的顺序为bdac,
,以上都是强碱弱酸盐,溶液都显示碱性,化学式中含有的弱酸根离子对应的酸的酸性越强,其水解程度越弱,溶液的pH越小,而酸性关系为:醋酸>碳酸>苯酚>碳酸氢根离子,则以上溶液的pH由大到小排列的顺序为bdac,
故答案为:bdac.
点评 本题考查了比较弱酸酸性强弱的方法,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握判断弱电解质酸性强弱常用的方法,试题培养了学生的分析能力及化学实验能力.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:解答题
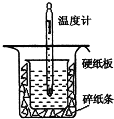 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
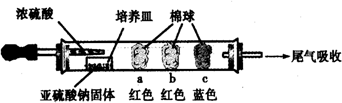
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | SO2具有漂白性,且为暂时性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 该气体具有还原性 (选填“氧化性”或“还原性”) |
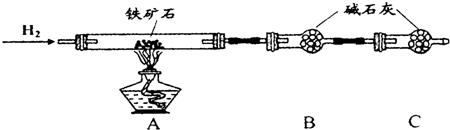
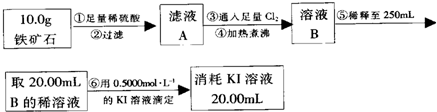
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
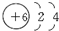 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲原子最外层电子数比乙原子最外层电子数少 | |
| B. | 甲原子电子层数比乙原子电子层数多 | |
| C. | 1mol甲从酸中置换生成的氢气比1mol乙从酸中置换生成的氢气多 | |
| D. | 常温下,甲能与水反应生成氢气,而乙不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 向滴有酚酞的NaOH溶液中 通入SO2 | 溶液红色褪去 | SO2具有漂白性 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com