
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
分析 (1)①增大压强,平衡向着方程式的系数减小的方向移动;
②升高温度,化学平衡向着吸热方向进行;
(2)据通过加热引发铝热反应以及铝热反应为放热反应以及温度升高化学反应速率加快;
(3)①根据温度和平衡常数以及反应的吸放热之间的关系来回答;
②计算1000℃时CO的转化率以及二氧化碳的平衡浓度,根据三行式计算比较.
解答 解:(1)mA?nB+pC△H,达到平衡状态.
①若A、B、C都是气体,增大压强,平衡向方式的系数减小的方向移动,即平衡向正反应方向移动,则m>n+p,故答案为:大于;
②其他条件不变,升高温度,化学平衡向着吸热方向进行,即加热后A的质量减小,则反应正向进行,△H>0,故答案为:大于;
(2)因通过加热引发铝热反应,所以开始速率为零,一旦反应,反应放热,温度不断升高,化学反应速率加快,故选:c;
(3)①该反应的K随着温度的升高而减小,所以反应释放热量,△H<0,故答案为:<;
②T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,
FeO(s)+CO(g)?Fe(s)+CO2(g)
初始浓度:0.3 0.3 0 0
变化浓度:0.15 0.15
平衡浓度:0.15 0.15
CO转化率为W1=$\frac{0.15}{0.3}$×100%=20%,c(CO2)=0.15mol•L-1,K=1>0.68,所以平衡正向移动了,该反应为放热反应,所以此时温度应低于1000℃,
由于氧化亚铁和铁都是固体,对平衡没有影响,该反应是气体计量数不变的反应,此时保持其它条件不变再充入2.0mol CO(g),则建立的平衡是等效的,所以再达平衡时测得CO转化率为W2=W1,
故答案为:低于;=.
点评 本题是一道关于化学平衡常数的计算题,考查生化学平衡移动原理以及三行式的计算知识,属于综合知识的考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
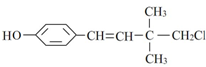 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 有顺反异构 | |
| B. | 可以和浓溴水发生取代反应和加成反应 | |
| C. | 可以发生加聚反应、水解反应和消去反应 | |
| D. | 1mol该化合物最多能与4 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 浓度为0.2mol/L的CH3COOH溶液和农地为0.1mol/L的NaOH溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | |
| C. | 醋酸溶液加少量水稀释,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$几乎不变 | |
| D. | amol/LCH3COOH溶液与bmol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CH3COO-),则一定有a≤b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,容器体积扩大一倍,A的浓度是原来的0.45倍,则a+b>c+d | |
| B. | 若从正反应开始,平衡时,A、B的转化率相等,则A、B的物质的量之比为b:a | |
| C. | 若平衡体系中共有气体n mol,再向其中充入bmolB,达到平衡时气体总物质的量为n+bmol,则a+b=c+d | |
| D. | 若a+b=c+d,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制取氢气 | |
| B. | 大量设立水电站,用电力分解水制取氢气. | |
| C. | 设法将太阳能聚焦,产生高温,使水分解产生氢气. | |
| D. | 寻找更多的化石燃料,利用其燃烧放热,使水分解产生氢气. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO2和CO2都属于酸性氧化物 | |
| B. | 甲烷和和一氯甲烷都属于烷烃 | |
| C. | 碱性氧化物都是金属氧化物 | |
| D. | 在水溶液中能电离出H+的化合物都属于酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com