
| A. | 当Al3+恰好完全沉淀时,消耗Ba(OH)22 mol | |
| B. | 当SO42-恰好完全沉淀时,Al3+全部转化为Al(OH)3 | |
| C. | 当向溶液中加入1.5mol Ba(OH)2时,反应可用下列离子方程式表示:2Al3++3 SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
分析 1molKAl(SO4)2中逐滴加入Ba(OH)2溶液,反应过程可分三个阶段:2KAl(SO4)2+3Ba(OH)2=K2SO4+2Al(OH)3↓+3BaSO4↓①;KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O②;
第一阶段:从开始滴入Ba(OH)2到1.5mol时,反应按①进行,溶液中的Al3+、Ba2+、OH-离子均转化成沉淀;
第二阶段:当滴入Ba(OH)2从1.5mol到2mol之间时,Ba2+继续与SO42-反应生成BaSO4,同时①反应生成的Al(OH)3与OH-反应生成AlO2-;
第三阶段:当滴入到Ba(OH)22mol时,按②进行,生成的Al(OH)3全部转化为AlO2-,共生成2molBaSO4.
解答 解:1molKAl(SO4)2中逐滴加入Ba(OH)2溶液,反应过程可分三个阶段:2KAl(SO4)2+3Ba(OH)2=K2SO4+2Al(OH)3↓+3BaSO4↓①;KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O②,
A.第一阶段:从开始滴入Ba(OH)2到1.5mol时,反应按2KAl(SO4)2+3Ba(OH)2=K2SO4+2Al(OH)3↓+3BaSO4↓①进行,即当1molAl3+恰好完全沉淀时,消耗氢氧化钡1.5mol,故A错误;
B.1mol KAl(SO4)2的溶液中含有2mol的SO42-,当SO42-恰好完全沉淀时,需要2mol的Ba2+,即消耗了2mol的Ba(OH)2,即KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O,Al3+全部转化为偏铝酸根离子,故B错误;
C.当向溶液中加入1.5mol氢氧化钡时,发生反应:2KAl(SO4)2+3Ba(OH)2=K2SO4+2Al(OH)3↓+3BaSO4↓,离子方程式表示为:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓,故C正确;
D.随加入的氢氧化钡的物质的量不断增大,开始沉淀量增多,随后氢氧化铝会溶解,故沉淀的物质的量先增大后减小,故D错误;
故选C.
点评 本题考查了离子方程式的书写及应用,侧重考查学生分析和解决问题的能力,明确铝及其化合物的性质是解答关键,注意掌握离子方程式的书写原则.


科目:高中化学 来源: 题型:选择题
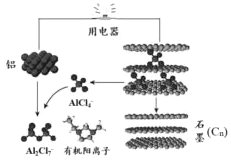 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 充电时的阳极反应为:Cn+AlCl4--e-=CnAlCl4 | |
| B. | 放电时,铝为负极、石墨为正极 | |
| C. | 放电时,有机阳离子向铝电极方向移动 | |
| D. | 放电时的负极反应为:Al-3e-+7AlCl4-=4Al2Cl7- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②⑥⑦ | B. | 只有⑦ | C. | ④⑤⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液,分别加水稀释至体积V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液,分别加水稀释至体积V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | XOH是弱碱 | |
| B. | pH=10的两种溶液中的c(X+ ):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32- )减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A. | 含0.5 mol HCl的稀溶液与含 0.55 mol NaOH的稀溶液混合 | 测得放出热量为a kJ | 强酸与强碱反应的中和热为2a kJ/mol |
| B. | 向CuCl2、MgCl2的混合溶液中滴加NaOH溶液 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C. | 将铁钉和铜丝用导线连接后放入滴有酚酞的氯化铵溶液中 | 铜丝附近溶液变红色 | 铁发生吸氧腐蚀 |
| D. | 向某未知溶液中滴加酸性KMnO4溶液 | KMnO4溶液褪色 | 溶液中有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
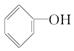 B.
B.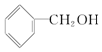 C.CH3 CH2-O-CH2CH3 D.CH3 OH E.CH3-O-CH3 F.HO-CH2CH2-OH
C.CH3 CH2-O-CH2CH3 D.CH3 OH E.CH3-O-CH3 F.HO-CH2CH2-OH查看答案和解析>>
科目:高中化学 来源: 题型:实验题
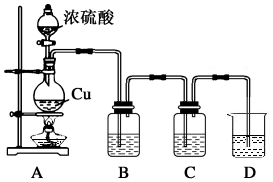
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.3 mol/L | D. | 0.4 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com