
【题目】对于反应2SO2+O2![]() 2SO3,下列判断正确的( )
2SO3,下列判断正确的( )
A. 标准状况下,2L SO2和足量O2反应最终生成2L SO3
B. 平衡时,再向容器中通入O2,可使SO2的转化率达到100%
C. 平衡时,SO2的消耗速率必定等于O2生成速率的二倍
D. 平衡时,SO2的浓度必定等于O2浓度的二倍
科目:高中化学 来源: 题型:
【题目】在下列叙述中,正确的是( )
A.氧气的摩尔质量是32
B.2molNaCl固体溶解于1L水所得溶液的物质的量浓度为2mol/L
C.标准状况下同体积的O2和O3中所含分子数相等
D.在标准状况下,体积为22.4L的物质都是1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)NaClO中Cl的化合价为__________,有较强的_________(填氧化、还原)性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_________。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为_____________________。
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
(3)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。在图示的转化中,化合价不变的元素是__________。该图示的总反应为_______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸式盐NaHY的水溶液c(OH-)>c(H+),下列叙述正确的是
A. H2Y的电离方程式:H2Y![]() 2H++Y2-
2H++Y2-
B. HY-的水解方程式:HY-+ H2O![]() H3O++ Y2-
H3O++ Y2-
C. 该酸式盐溶液中离子浓度关系:c(Na+)>c(HY-)>c(OH-)>c(H+)
D. 该酸式盐溶液中离子浓度关系:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴有BaCl2和KCl的混合溶液V L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a mol H2SO4;另一份滴加AgNO3溶液,消耗b mol AgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为______mol/L。
⑵下列微粒:①S ②SO32- ③ Fe2+ ④Al3+ ⑤Na ⑥HCl ⑦Na2O2在化学反应中只能被氧化的是______![]() 填序号
填序号![]() ,只能表现出氧化性的是______
,只能表现出氧化性的是______![]() 填序号
填序号![]() 。
。
⑶一定条件下, PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为______mol;
⑷在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为______。
⑸自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2发生的反应可表示如下,请完成方程式的配平。____Al + ____NO3-+ ________ == ____AlO2- + ____N2↑ +____ H2O,
⑹某化学反应的反应物和产物:![]()
①该反应的氧化产物是______。
②若该反应方程式中I2和KIO3的计量数分别是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4 + KI + H2SO4→______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了有效实现NO和NO2的相互转化,设计如下实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。
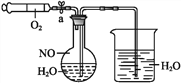
(1)打开止水夹,推动针筒活塞,使O2进入圆底烧瓶。关闭止水夹,首先观察到圆底烧瓶中的现象为_________,产生此现象的化学反应方程式为__。
(2)轻轻摇动圆底烧瓶,观察到圆底烧瓶中的现象为①___________;②________。产生此现象的化学反应方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )

A. 盐酸中逐滴加入氢氧化钠溶液
B. 硫酸铜溶液中逐滴加入氢氧化钡溶液
C. 硫酸中逐滴加入氯化钡溶液
D. 盐酸中逐滴加入硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为1 L的恒容密闭容器中按不同方式投入反应物,发生反应CO(g)+2H2(g)![]() CH3OH(g)(正反应放热),测得反应的相关数据如下:
CH3OH(g)(正反应放热),测得反应的相关数据如下:
容器 | 容器1 | 容器2 | 容器3 |
反应温度T/K | 500 | 500 | 600 |
反应物投入量 | 1 mol CO、 2 mol H2 | 2 mol CH3OH | 1 mol CO、 2 mol H2 |
平衡v正(H2)/(mol·L-1·s-1) | v1 | v2 | v3 |
平衡c(CH3OH)/(mol·L-1) | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的转化率α | α1(CO) | α2(CH3OH) | α3(CO) |
平衡常数K | K1 | K2 | K3 |
下列叙述正确的是( )
A. v1<v2,2c1>c2B. α1(CO)>α3(CO),v1<v3
C. p2>2p3,K1<K3D. c2>2c3,α2(CH3OH)+α3(CO)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g) ![]() 2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.VA=0.15mol(Lmin)﹣1 B.VB=0.6 mol(Lmin)﹣1
C.VC=0.4 mol(Lmin)﹣1 D.VD=0.01 mol(Ls)﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com