
| A. | Na+、H+、Cl-、SO42- | B. | Na+、H+、Cl-、HCO3- | ||
| C. | Al3+、K+、OH-、NO3- | D. | NH4+、OH-、NO3-、Na+ |
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
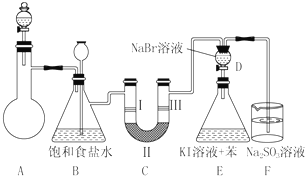
| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青石棉是一种易燃品且易溶于水 | |
| B. | 青石棉的化学组成用氧化物的形式可表示为:Na2O•FeO•2Fe2O3•8SiO2•H2O | |
| C. | 1 mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗6 L 3 mol•L-1 HNO3溶液 | |
| D. | 1 mol Na2Fe5Si8O22(OH)2与足量氢氟酸作用,至少需消耗5.5 L 2 mol•L-1HF溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
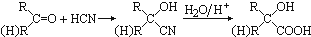 ,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按下列路线合成:
,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按下列路线合成: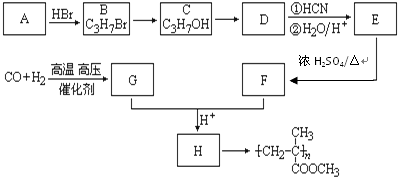
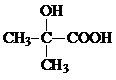 ;
; ;
;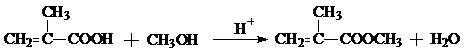 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .请写出1-丙醇与乙酸反应的化学方程式为CH3CH2CH2OH+CH3COOH
.请写出1-丙醇与乙酸反应的化学方程式为CH3CH2CH2OH+CH3COOH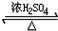 CH3COOCH2CH2CH3+H2O
CH3COOCH2CH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)═c(NO3-) | |
| B. | 0.1mol/L某二元弱酸强碱盐NaHA溶液中:c(Na+)═2c(A2-)+c(HA-)+c(H2A) | |
| C. | 10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 常温下,0.1mol/L pH=4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com