
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1
热化学方程式:Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) △H= kJ·mol-1。
(2)氢化亚铜是一种红色固体,可由下列反应制备4CuSO4 + 3H3PO2 + 6H2O = 4CuH↓ + 4H2SO4 + 3H3PO4
①该反应还原剂是 (写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为 mol。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如右图所示。
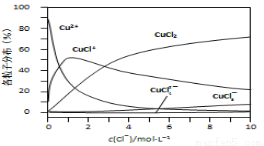
①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
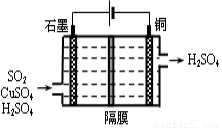
(4)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 。
②利用上图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
科目:高中化学 来源:2015-2016学年福建省高二上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.食物在常温下腐败是自发进行的 B.凡是放热反应都是自发的
C.自发反应都是熵增大的反应 D.电解池的反应属于自发反应
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川市高三上学期统练(三)化学试卷(解析版) 题型:选择题
用NaOH溶液滴定盐酸时,由于滴定速度太快,当混合溶液变红时不知NaOH是否过量,判断它是否过量的方法是
A.加入5mL盐酸再进行滴定 B.返滴一滴待测盐酸
C.重新进行滴定 D.以上方法均不适用
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第三次考试化学试卷(解析版) 题型:填空题
H、C、N、O、Fe、Si、I是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)根据元素周期律,碳的非金属性强于硅,请用一个化学反应方程式表示___________________。
(2)若FeSO4和O2的系数比为2:1,试配平下列方程式:__FeSO4+__K2O2→__K2FeO4+__K2O+__K2SO4+__O2↑
(3)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOX)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:NO2+NO+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
现有一NO与NO2的混合气体,将其通入50mL 2mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3― 0.02mol。
①所得溶液中NaNO2的物质的量为 mol;
②混合气体中V(NO):V(NO2)= 。
(4)向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)的变化可用下图简单表示
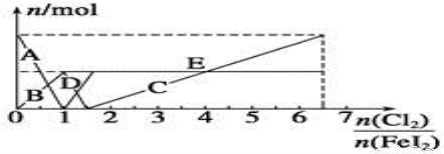
①当n(Cl2)∶n(FeI2)=6.5时,溶液中n(Cl-)∶n(IO3-)= 。
②当n(Cl2)∶n(FeI2)=1.2时,离子方程式可表示为 。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期期中考试化学试卷(解析版) 题型:选择题
已知6.0g NaOH和6.4g S混合后加热,恰好发生如下反应:aNaOH + bS → cNa2Sx + dNa2S2O3 + eH2O,则x的值为( )
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三第四次(12月)月考化学试卷(解析版) 题型:选择题
下列有关化学用语表述正确的是
A.S2-的结构示意图:
B.Na2S的电子式:
C.邻羟基苯甲酸的结构简式:
D.质子数与中子数相等的硫原子: S
S
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期第八次大考化学试卷(解析版) 题型:实验题
化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:

I.图A为教材制备乙酸乙酯的实验装置,甲同学认为图B装置比A要好,则冷却水应从_______口进入;乙同学认为图C装置效果更好,理由是________________。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)【提出猜想】小组同学认为分解产物可能有以下几种情况:
A.Fe2O3 SO2 NH3 H2O B.FeO SO3 NH3 H2O
C.FeO SO2 NH3 H2O D.Fe2O3 SO3 SO2 NH3 H2O
根据所学知识,可确定______________不成立(填序号)
(2)【药品验纯】甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和__________溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加______________(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)【实验探究】为检验分解产物,甲同学设计了如下实验装置。

①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是__________。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为_____。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含_______。
(4)【实验结论与反思】通过实验现象和认真反思,上述猜想中一定正确的是_________(填序号)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:实验题
现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中
定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_____作指示剂。
(3)读取盛装0.100 0 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
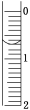
(4)滴定。滴定终点的现象是__________________________________________。
Ⅱ.数据记录:
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) (mL) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) (mL) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理:
某同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4 mL=15.24 mL。
(5)指出他的计算的不合理之处:__________;按正确数据处理,可得市售白醋总酸量=_____g/100 mL。(结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源:2015-2016宁夏回族自治银川一中高一上期中考试化学试卷(解析版) 题型:填空题
氯化钠是日常生活的必需品,也是重要的化工原料。
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。

提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、 、 ;
②在滤液中加盐酸的作用是 ;
(2)用提纯的NaCl配制200g0.9%的生理盐水,需要NaCl的质量为 g。配制该溶液时所需要的玻璃仪器有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com