
【题目】已知A、B、C、D、X、Y六种物质均由短周期元素组成,其中X为常见离子化合物,它们之间的转换关系如下图所示

(1)已知条件I和条件II相同,则该反应条件为____________________ 。
(2)物质X的电子式为_____________________ 。
(3)写出B与Ca(OH)2反应的化学方程式______________________________ 。
(4)写出X在条件II下反应生成B、C、D的离子方程式_____________________________________________ 。
(5)写出实验室制B的化学方程式,并标出电子转移方向、数目____________________________________________ 。
(6)请简述鉴定物质X的实验方法____________________________________。
【答案】通电 ![]() 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2Cl-+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 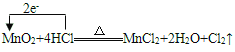 (用双线桥表示也可) 用焰色反应检验Na+,用硝酸银和稀硝酸检验Cl-
(用双线桥表示也可) 用焰色反应检验Na+,用硝酸银和稀硝酸检验Cl-
【解析】
X为离子化合物,左边为熔融液,右边为水溶液,说明X易溶于水,则只可能为NaCl、MgCl2。若X为MgCl2,电解其水溶液,生成Mg(OH)2、H2、Cl2,电解其熔融液时,生成Mg、H2。则B为Cl2,A为Mg,但Mg生成Mg(OH)2时,需要与水反应,而Mg与H2O不反应,所以X只能为NaCl。从而得出A为Na,B为Cl2,C、D为NaOH、H2中的一种,Y为H2O。
(1)已知条件I和条件II相同,则该反应条件为通电。
(2)物质X为NaCl,由此可写出其电子式。
(3)Cl2与Ca(OH)2反应,用于生产漂白粉。
(4)X为NaCl,在条件II下,电解氯化钠的水溶液,反应生成NaOH、Cl2、 H2。
(5)实验室制Cl2是利用MnO2与浓盐酸在加热条件下制得。
(6)鉴定物质NaCl时,既要鉴定Na+,又要鉴定Cl-。
(1)已知条件I和条件II相同,则该反应条件为通电。答案为:通电;
(2)物质X为NaCl,其电子式为![]() 。答案为:
。答案为:![]() ;
;
(3)Cl2与Ca(OH)2反应,化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)X为NaCl,在条件II下,电解氯化钠的水溶液,反应的离子方程式为2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑。答案为:2Cl-+2H2O
2OH-+Cl2↑+H2↑。答案为:2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑;
2OH-+Cl2↑+H2↑;
(5)实验室制Cl2是利用MnO2与浓盐酸在加热条件下制得,表示电子转移方向和数目的方程式为 。答案为:
。答案为: (用双线桥表示也可);
(用双线桥表示也可);
(6)鉴定物质NaCl时,既要鉴定Na+,又要鉴定Cl-,鉴定Na+用焰色反应,鉴定Cl-用硝酸银和稀硝酸。答案为:用焰色反应检验Na+,用硝酸银和稀硝酸检验Cl-。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下面是元素周期表的草图,表中所列字母代号分别代表某一种元素,请回答:

(1)表中最活泼的金属与最活泼的非金属形成的物质是__________________(填化学式)。
(2)由a、d两种元素可形成两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:_____________________,
(3)e、f、k、m对应的单原子离子的半径由大到小的顺序为__________(填离子符号)。
(4)d、m对应的离子还原性由强到弱顺序为_________________________(填离子符号)。
(5)d、e、m的气态氢化物中,最不稳定的是________________________(填分子式)。
(6)用电子式表示n与m形成的原子个数比2∶1的化合物的形成过程:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为9NA
B.56g铁在足量氧气中完全燃烧,转移的电子数小于3NA
C.16g O2和14C2H4的混合物中所含中子数为8NA
D.常温下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。
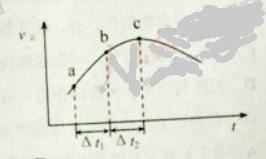
A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表达不正确的是( )
①丙烷的球棍模型 ②丙烯的结构简式为CH3CHCH2
②丙烯的结构简式为CH3CHCH2
③某有机物的名称是2,3-二甲基戊烷 ④![]() 与C8H6互为同分异构体
与C8H6互为同分异构体
A. ①②B. ②③C. ②④D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Al(OH)3的性质叙述中错误的是( )
A.Al(OH)3能凝聚水中的悬浮物,还能吸附色素
B.Al(OH)3是难溶于水的白色固体
C.Al(OH)3可溶于过量的浓氨水
D.Al(OH)3受热能分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药爆炸时发生化学反应:S+2KNO3+3C→K2S+3CO2↑+N2↑,完成下列填空:
(1)上述反应涉及的元素中,非金属性最强的是___,试写出属于第二周期的元素的原子半径大小有___>___>___。(填元素符号)
(2)上述反应的生成物中,属于离子化合物的是___,其电子式为___。
(3)硫元素的气态氢化物所含化学键类型为___(填“离子键”或“共价键”),其水溶液长期遭空气中放置容易变浑浊,用化学方程式表示该变化___,该变化体现出硫元素的非金属性比氧元素___(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
温度 | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
A.ΔH>0
B.1000℃时,在固定体积的密闭容器中,某时刻测得上述体系中,CO、CO2的物质的量分别为0.5 mol、1.8 mol,此时反应向正反应方向进行
C.其他条件不变,向平衡体系充入CO2气体,K值减小
D.其他条件不变,升高温度,可以提高CO的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是

A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com