
分析 (1)铁置换出Cu,Cu置换出Ag,氧化还原反应中还原剂的还原性大于还原产物的还原性,氧化剂的氧化性大于氧化产物分析;
(2)根据同种还原剂(变价金属)与不同氧化剂反应,金属的价态来分析氧化性,氧化还原反应氧化剂的氧化性大于氧化产物;
(3)Pb2+和Sn4+的化合物较为稳定,说明Pb4+不稳定易得电子,Sn2+不稳定易失电子;
①PbO2易得电子具有氧化性;SnCl2易失电子具有还原性;PbO2能把HCl氧化为氯气;SnCl2和FeCl3溶液反应生成SnCl4和FeCl2;
②根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性分析.
解答 解:(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则铁置换出Cu,Cu置换出Ag,所以还原剂Fe>Cu>Ag,Cu2+、Fe2+、Ag+中氧化性强弱为Ag+>Cu2+>Fe2+,氧化性最强的是Ag+;
故答案为:Fe;Ag+;
(2)Fe在氯气中被锈蚀成棕褐色物质(FeCl3),而在盐酸中生成淡绿色溶液(FeCl2),则具有氧化性的离子为Cl2、H+,氯气得电子的能力强,则Cl2、Cl-、H+中,氧化性最强的微粒是Cl2,则发生的反应为:3Cl2+2Fe═2FeCl3;Fe+2HCl═FeCl2+H2↑;
故答案为:Cl2、H+;Cl2;3Cl2+2Fe═2FeCl3;Fe+2HCl═FeCl2+H2↑;
(3)Pb2+和Sn4+的化合物较为稳定,说明Pb4+不稳定易得电子,Sn2+不稳定易失电子;
①Pb4+不稳定易得电子,则PbO2易得电子具有氧化性;Sn2+不稳定易失电子,则SnCl2易失电子具有还原性;PbO2能把HCl氧化为氯气,其反应的离子方程式为:PbO2+4H++2Cl-═Pb2++2H2O+Cl2↑;SnCl2和FeCl3溶液反应生成SnCl4和FeCl2,其反应的离子方程式为:2Fe3++Sn2+═2Fe2++Sn4+;
故答案为:氧化;还原;PbO2+4H++2Cl-═Pb2++2H2O+Cl2↑;2Fe3++Sn2+═2Fe2++Sn4+;
②由氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:PbO2>Cl2>Fe3+>Sn4+;
故答案为:PbO2>Cl2>Fe3+>Sn4+.
点评 本题考查离子反应方程式的书写及氧化还原反应,明确发生的化学反应是解答本题的关键,并熟悉离子反应方程式的书写方法、氧化性、还原性的比较方法来解答,题目难度中等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化铁中滴加稀盐酸溶解:FeO+2H+═Fe2++H2O | |
| B. | 用稀硫酸、双氧水除去FeCl3溶液中的FeCl2杂质:Fe2++2H++H2O2═Fe3++2H2O | |
| C. | 硫酸铝溶液中滴加氨水制取氢氧化铝:Al3++3OH-═Al(OH)3↓ | |
| D. | 向NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+2OH-+Ca2+═2H2O+CaCO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铊的相关信息卡片如图所示:
铊的相关信息卡片如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 | |
| B. | 温度、压强一定时,放热的熵增加的反应一定能自发进行 | |
| C. | 反应焓变是决定反应是否自发进行的唯一因素 | |
| D. | 固体的溶解过程与熵变有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6L | B. | 11.2L | C. | 2.24L | D. | 4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;D若为纯净物,D的核磁共振氢谱存在2种吸收峰,面积比为1:1;
;D若为纯净物,D的核磁共振氢谱存在2种吸收峰,面积比为1:1; ,反应类型:消去反应;
,反应类型:消去反应;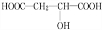 +HCOOH$?_{△}^{浓硫酸}$
+HCOOH$?_{△}^{浓硫酸}$ +H2O,反应类型:取代反应;
+H2O,反应类型:取代反应; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氯化铁溶液中加入铁粉:Fe3++Fe═2Fe2+ | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+C6H5O-→C6H5OH+HCO3- | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++4Cl-═Mn2++Cl2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com