
分析 金属元素组成的单质为金属单质,
非金属元素 组成的单质为非金属单质,
酸是指电离时生成的阳离子全部是氢离子的化合物,
碱是指电离时生成的阴离子全部是氢氧根离子的化合物,
氧化物是指由两种元素组成,其中一种是氧元素的化合物.
解答 解:金属元素组成的单质为金属单质,非金属元素 组成的单质为非金属单质,酸是指电离时生成的阳离子全部是氢离子的化合物,碱是指电离时生成的阴离子全部是氢氧根离子的化合物,盐是指由金属离子和酸根离子构成的化合物,氧化物是指由两种元素组成,其中一种是氧元素的化合物,Cu、Fe是金属单质、S、H2、属于非金属单质,HCl、H2SO4属于酸,Ba(OH)2、NaOH属于碱,K2O、CuO属于金属氧化物,NaHCO3、NaCl属于盐;树状分类图为: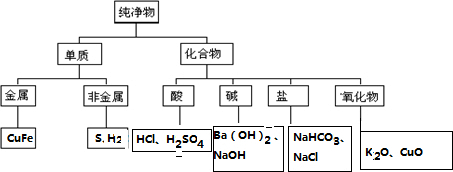 ;
;
故答案为: .
.
点评 本题考查了物质分类方法和物质组成和概念的应用,物质的分类知识是考查的热点之一,透彻理解有关概念,明确概念间的相互关系是解题的关键,题目较简单.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 据反应3NO2+H2O═2HNO3+NO可知,NO2是HNO3的酸酐 | |
| B. | 据反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O和3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,可知浓HNO3的氧化性不如稀HNO3强 | |
| C. | 据反应2NO2(g)?N2O4(g)△<0可知要制得较纯净的NO2,需高温、低压环境 | |
| D. | NO2、Br2(g)同为红棕色气体,可用湿润的淀粉-KI试纸鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中Cl-、N、Na+、S可以大量存在 | |
| B. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| C. | 向无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显紫色,说明原溶液中有I- | |
| D. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═S+2I-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钙、熟石灰、CaO、碱性氧化物 | B. | 氢氯酸、盐酸、HCl、酸 | ||
| C. | 碳酸钠、纯碱、Na2CO3、碱 | D. | 硫酸铜、胆矾、CuSO4、盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
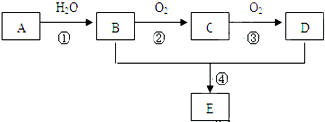
 是重要的化工原料,其合成过程如图:
是重要的化工原料,其合成过程如图:
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com