
| A. | Ag+、NO3-、Cl-、K+ | B. | Na+、Fe2+、Cl-、NO3- | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Cu2+、NH4+、Br-、Cl- |
科目:高中化学 来源: 题型:填空题
 ,系统命名的名称为2,3-二甲基-2-丁烯.
,系统命名的名称为2,3-二甲基-2-丁烯.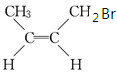 反式
反式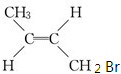 若用丙烯制取1,2,3-三溴丙烷,最适合的方法是先溴单质与丙烯在高温下发生α-H取代反应生成生成3-溴丙烯再让3-溴丙烯和溴单质加成,此时才能得到1,2,3-三溴丙烷.
若用丙烯制取1,2,3-三溴丙烷,最适合的方法是先溴单质与丙烯在高温下发生α-H取代反应生成生成3-溴丙烯再让3-溴丙烯和溴单质加成,此时才能得到1,2,3-三溴丙烷.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
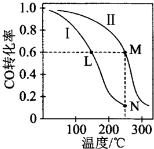
| A. | 该反应的△H>0 | |
| B. | N点化学平衡常数K=0.59 | |
| C. | L、M两点容器内压强:P(M)>2P(L) | |
| D. | 向N点平衡体系中再加入1 mol CH3OH,建立新平衡时被分解的CH3OH物质的量小于0.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
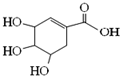
| A. | 分子式为C7H6O5 | |
| B. | 分子中的碳原子都在同一平面 | |
| C. | 可发生加成和取代反应 | |
| D. | 在水溶液中羟基和羧基均能电离出氢离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
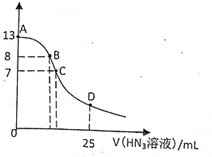
| A. | 水电离出的c(H+):A点小于B点 | |
| B. | 在B点,离子浓度大小为c(OH-)>c(H+)>c(Na+)>c(N3-) | |
| C. | 在C点,滴加的V(HN3)=12.5 mL | |
| D. | 在D点,c(Na+)=2c(HN3)+2 c(N3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com