
| A、NaNO3 |
| B、NH4Cl |
| C、H2SO4 |
| D、SiO2 |


科目:高中化学 来源: 题型:
| A、溶液变为红色 |
| B、可以听到“嘶嘶”的响声 |
| C、钠熔化成闪亮的小球 |
| D、钠在水面上四处游动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B、28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA |
| C、常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 NA |
| D、常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4?14H2O | ||
| B、CH4?8H2O | ||
C、CH4?7
| ||
| D、CH4?6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
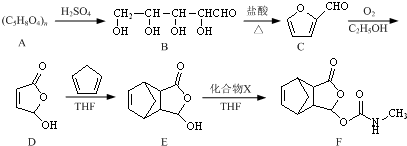
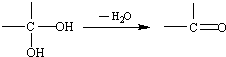
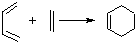
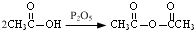
 和
和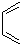 为原料合成
为原料合成 ,请设计合成路线(注明反应条件).
,请设计合成路线(注明反应条件).| 浓硫酸 |
| 170℃ |
| Br2 |
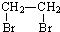
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com