
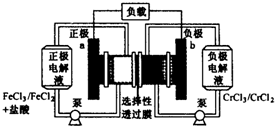
 ����������ԭҺ�������һ�ֵͳɱ��Ĵ��ܵ�أ���ؽṹ����ͼ��ʾ������ԭ��Ϊ��Fe3++Cr2+$?_{���}^{�ŵ�}$Fe2++Cr3+������˵����ȷ���ǣ�������
����������ԭҺ�������һ�ֵͳɱ��Ĵ��ܵ�أ���ؽṹ����ͼ��ʾ������ԭ��Ϊ��Fe3++Cr2+$?_{���}^{�ŵ�}$Fe2++Cr3+������˵����ȷ���ǣ�������| A�� | ��س��ʱ��b���ĵ缫��ӦʽΪCr3++e-=Cr2+ | |
| B�� | ��س��ʱ��Cl-��a������ѡ������Ĥ����b�� | |
| C�� | ��طŵ�ʱ��a���ĵ缫��ӦʽΪFe3++3e-=Fe | |
| D�� | ��طŵ�ʱ����·��ÿͨ��0.1mol���ӣ�Fe3+Ũ�Ƚ���0.1 mol•L-1 |
���� ����������ԭҺ����ص�ع���ʱ���ŵ�ʱ����������ԭҺ����طŵ�ʱ��Cl-�����������������缫��ӦΪ��Cr2+=Cr3++e-���淴Ӧ�ͳ��ʱ��������Ӧ��ͬ�����ʱ����������������ʧȥ���ӷ���������Ӧ����Fe2+ʧ��������Fe3+���缫��ӦΪ��Fe2+-e-�TFe3+���淴Ӧ�ͷŵ�ʱ�����ϵķ�Ӧ��ͬ������ԭ��غ͵��صĹ���ԭ�����ش��жϼ��ɣ�
��� �⣺A�����ʱ�ǵ��ع���ԭ����bΪ���������������õ��ӵĻ�ԭ��Ӧ���缫��ӦʽΪCr3++e-=Cr2+����A��ȷ��
B����س��ʱ��Cl-�������Ҵ���ѡ������Ĥ���������ң�����b��a����B����
C����طŵ�ʱ����ԭ��صĹ���ԭ����a��������������ԭ��Ӧ��Fe3++e-=Fe2+����C����
D���ŵ�ʱ����·��ÿ����0.1mol���ӣ��ͻ���0.1mol�������ӵõ��ӣ���СŨ�Ⱥ�����йأ���D����
��ѡA��
���� ���⿼��ѧ�����ε�صĹ���ԭ��֪ʶ������ѧ����ԭ��غ͵��ع���ԭ�������գ��ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �״�������ˮ������Ӧ������������Ӧ����ʽ���£�CH3OH��g��+H2O��g��?CO2��g��+3H2��g����H��0
�״�������ˮ������Ӧ������������Ӧ����ʽ���£�CH3OH��g��+H2O��g��?CO2��g��+3H2��g����H��0�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A | B | C | D | |
| ��Ʒ���� | ú̿  | ��ȩ��֬�ֱ� | ����  | �ֹ�����  |
| ��Ҫ�ɷ� | C ̼���� | 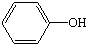 ���� | Al2��SO4��3•12H2O ʮ��ˮ�������� | C17H35COONa Ӳ֬���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮӦ��������ɫ�Լ�ƿ�ڣ�2HClO$\frac{\underline{\;����\;}}{\;}$H2O+Cl2�� | |
| B�� | ��ˮ����ɱ����Ư�����ã�Cl2+H2O?HCl+HClO | |
| C�� | ����ˮ�ε�����KI��ֽ�ϣ���ֽ������Cl2+2I-=2Cl-+I2 | |
| D�� | ��ʵ������Ư��Һ������ϡ������ȡ������ˮ��ClO-+Cl-+2H+=Cl2+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
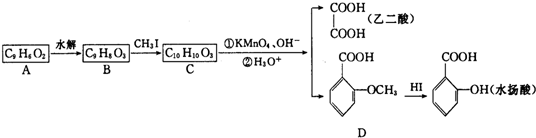
 ��
��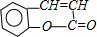 +H2O$\stackrel{��}{��}$
+H2O$\stackrel{��}{��}$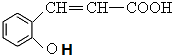 ��
��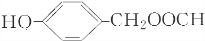 ��
�� ��
��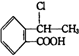 �ϳ�
�ϳ�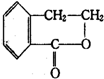 ��������ԭ����ѡ���÷�Ӧ����ͼ��ʾ����ע����Ӧ��������ʾ����ԭ��$��_{����}^{�Լ�}$�����
��������ԭ����ѡ���÷�Ӧ����ͼ��ʾ����ע����Ӧ��������ʾ����ԭ��$��_{����}^{�Լ�}$������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
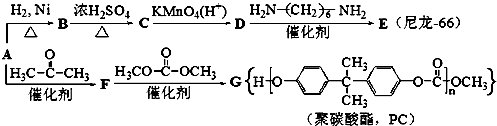
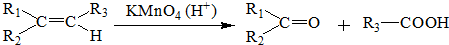
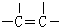 ��
��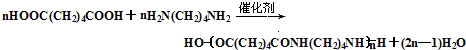 ��
��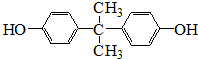 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | S$\stackrel{O_{2}/��ȼ}{��}$SO3$\stackrel{H_{2}O}{��}$H2SO4 | |
| B�� | Cu2��OH��2CO3$\stackrel{H_{2}SO_{4}}{��}$CuSO4��aq��$\stackrel{Na}{��}$Cu | |
| C�� | SiO2$\stackrel{C/����}{��}$Si$\stackrel{Cl_{2}/����}{��}$SiCl4$\stackrel{H_{2}/����}{��}$Si | |
| D�� | Mg��OH��2$\stackrel{����}{��}$MgCl2��aq��$\stackrel{��}{��}$MgCl2��s��$\stackrel{���}{��}$Mg |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ӧ�������淴Ӧ���������Ϊ�� | |
| B�� | A��B��C��Ũ�Ȳ��ٱ仯 | |
| C�� | A��B��C�����ʵ������ | |
| D�� | A��B��C�ķ�����Ŀ��Ϊ1��3��2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com