
| A. | 煤和石油都是可再生资源 | |
| B. | 可以分离煤焦油获取苯 | |
| C. | 煤的气化和石油的分馏都属于物理变化 | |
| D. | 石油的裂化仅能得到烷烃 |
科目:高中化学 来源: 题型:选择题
| 选项 | 目 的 | 分离方法 | 原 理 |
| A | 除去丁醇中的乙醇 | 蒸馏 | 丁醇与乙醇的沸点相差较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
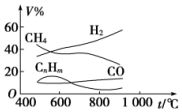 煤的气化是煤高效、洁净利用的方向之一.如图为加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知该煤气中( )
煤的气化是煤高效、洁净利用的方向之一.如图为加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知该煤气中( )| A. | 只含有碳、氢两种元素 | B. | 所含的有机物是CH4、CnHm | ||
| C. | CO体积分数大于CH4体积分数 | D. | 低温有助于提高H2的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
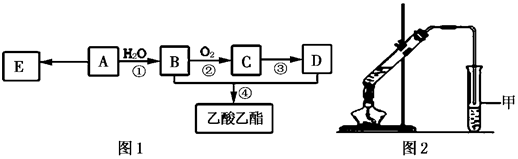
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 ,关于苧烯的说法正确的是( )
,关于苧烯的说法正确的是( )| A. | 苧烯的分子式为C10H16,属于芳香族化合物 | |
| B. | 苧烯分子中所有碳原子可能均处于同一平面上 | |
| C. | 苧烯能使酸性KMnO4溶液褪色 | |
| D. | 1 mol苧烯与足量浓溴水反应时,最多消耗2mol Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2017年5月9日,中国科学院、国家语言文字工作委员会、全国科学技术名词审定委员会在京联合发布了115号等4个新合成元素的中文定名.115号定名为“镆”,在周期表中有关信息如右图所示,下列说法不正确的是( )
2017年5月9日,中国科学院、国家语言文字工作委员会、全国科学技术名词审定委员会在京联合发布了115号等4个新合成元素的中文定名.115号定名为“镆”,在周期表中有关信息如右图所示,下列说法不正确的是( )| A. | 该元素为金属元素,元素符号为“Mc” | |
| B. | 该元素为放射性元素 | |
| C. | 该元素原子核外电子数为115 | |
| D. | 该元素位于第七周期ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com