
【题目】硫代硫酸钠(Na2S2O3)为白色结晶粉末,易溶于水,在中性或碱性条件下稳定,在酸性条件下发生反应(S2O32-+2H+=S↓+SO2+H2O),是一种重要的化工原料。请回答下列问题:
(1)Na2S2O3溶液可用作照相底片(AgBr)中的定影剂,其原理是将未感光的AgBr转化为可溶于水的稳定络合物Na3[Ag(S2O3)2]。写出该络合反应的离子方程式___。
(2)工业上利用硫化碱残渣(主要成分Na2S,Na2CO3)与硫黄废气(主要成分SO2)反应,经吸硫、蒸发、结晶,制得硫代硫酸钠。巳知该反应中C(碳)原子化合价不变,则氧化剂和还原剂物质的量之比为___。
(3)Na2S2O3长期暴露在空气中易被氧化生成Na2SO4,设计实验方案检验Na2S2O3是否变质(已知BaS2O3微溶于水)___。
(4)现有含Na2S2O3·5H2O的样品,用以下方法计算Na2S2O3·5H2O的质量分数。
a.取样品7.0g溶于蒸馏水中,并定容至500mL容量瓶中待用。
b.取0.01mol.L-1的K2Cr2O7标准溶液20.00mL于锥形瓶中,加过量KI溶液并酸化,加2滴淀粉指示剂,用a中未知浓度的Na2S2O3待测液滴定至终点,共用去25.00mL。(已知2S2O32-+I2=S4O62-+2I-),在酸性环境中Cr2O72-被还原为绿色的Cr3+)。
回容下列问题:
①滴定终点的现象是___。
②样品中Na2S2O3·5H2O的质量分数为___(保留2位有效数字)。
【答案】2S2O32- + AgBr = [Ag(S2O3)2]3- + Br- 2:1 取少量样品于试管中,加过量稀盐酸,充分反应后,静置,向上层清液中加入氯化钡溶液,若有白色沉淀生成,则已氧化变质,反之,则未氧化变质 滴入最后一滴待测液,溶液蓝色变为浅绿色,且半分钟内不恢复 85%
【解析】
⑴根据题中信息可以写出方程式;
⑵利用氧化还原反应中得失电子守恒分析得出;
⑶检验Na2S2O3是否氧化变质,只要检验硫代硫酸钠中是否含Na2SO4;
⑷重铬酸根和碘离子反应生成单质碘,加入淀粉变为蓝色,用硫代硫酸钠滴定单质碘,最终碘单质完全消耗,蓝色消失;利用关系式确定重铬酸根和硫代硫酸根之间比例关系,计算即可。
⑴Na2S2O3溶液将未感光的AgBr转化为可溶于水的稳定络合物Na3[Ag(S2O3)2]。该络合反应的离子方程式2S2O32-+ AgBr=[Ag(S2O3)2]3-+ Br-,
故答案为2S2O32-+ AgBr=[Ag(S2O3)2]3-+ Br-;
⑵工业上利用硫化碱残渣(主要成分Na2S,Na2CO3)与硫黄废气(主要成分SO2)反应,经吸硫、蒸发、结晶,制得硫代硫酸钠,已知该反应中C(碳)原子化合价不变,Na2S中S的化合价由-2价升至+2价,Na2S为还原剂,SO2中S的化合价由+4价降至+2价,SO2为氧化剂,根据得失电子守恒,氧化剂SO2与还原剂Na2S物质的量之比为2:1,
故答案为2:1;
⑶Na2S2O3长期暴露在空气中易被氧化生成Na2SO4,要检验Na2S2O3是否变质即检验Na2S2O3中是否含Na2SO4,由于BaS2O3微溶于水,所以加BaCl2溶液之前先用HCl排除Na2S2O3的干扰,则实验方案为:取少量样品于试管中,加过量稀盐酸,充分反应后,静置,向上层清液中加入氯化钡溶液,若有白色沉淀生成,则已氧化变质,反之,则未氧化变质;
故答案为:取少量样品于试管中,加过量稀盐酸,充分反应后,静置,向上层清液中加入氯化钡溶液,若有白色沉淀生成,则已氧化变质,反之,则未氧化变质;
⑷①滴定前溶液呈蓝色,滴定终点I2被完全消耗,蓝色消失,因此滴定终点的现象是:滴入最后一滴待测液,蓝色变为浅绿色,且半分钟内不恢复,
故答案为滴入最后一滴待测液,蓝色变为浅绿色,且半分钟内不恢复;
②K2Cr2O7与I-反应的方程式为Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2与Na2S2O3的反应为I2+2S2O32-=S4O62-+2I-,得出关系式:

解得n = 1.2×10-3 mol,
因此总的物质的量为n = 1.2×10-3 mol×![]() =2.4×10-2 mol,
=2.4×10-2 mol,
质量分数ω=![]() ×100%=85%,
×100%=85%,
故答案为85%。


科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 苯酚钠溶液中通入少量的二氧化碳,产物是苯酚和碳酸钠
B. 苯的同系物中,苯环和侧链相互影响,使得二者均易被氧化
C. ![]() 在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶2
在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶2
D. 苯甲酸、苯乙烯分子中的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法不正确的是( )
A.向0.1mol·L-1 CH3COONa溶液中加入少量水,溶液中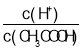 减小
减小
B.将FeCl3溶液和Fe2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分不同
C.向盐酸中加入氨水至中性,溶液中![]() =1
=1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
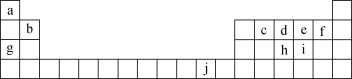
【题目】下表为元素周期表的一部分,表中所列的字母分别代表一种化学元素。
回答下列问题:
(1)写出元素f的基态原子核外电子排布式:____。
(2)写出元素h的基态原子核外电子轨道表示式:________。
(3)基态b原子电子占据最高能级的电子云轮廓图为_________
(4)ce2分子的电子式为____。
(5)d、g、h的原子半径由小到大的顺序是_______(用元素符号表示)
(6)用一个化学方程式证明e、i的非金属性的强弱_________。
(7)d的简单氢化物比h的简单氢化物沸点____(填“高”或“低”),请分析其原因____,写出j的原子结构示意图_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型漂白剂(结构如图)可用于漂白羊毛、草等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( )
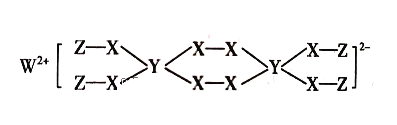
A.元素电负性顺序为:X>W>Y
B.Y的最高价氧化物对应水化物为强酸
C.工业上通过电解熔融的WX来制得W
D.该漂白剂中X、Y均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃 X分子中碳与氢的质量比为 36∶7。现取两支试管,分别加入适量溴水,实验操作及现象如下:

有关 X 的说法正确的是
A.相同条件下,X 的密度比水大
B.X的分子式为C6H14,X的同分异构体共有 6 种
C.X 能与 Br2发生加成反应使溴水褪色
D.试验后试管 2 中的有机层是上层还是下层,可通过加水确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常用于制造医药品,染料等。某化学小组在实验室利用纯净干燥的氯气和二氧化硫反应制取硫酰氯,所需实验装置如图所示(部分装置略)。
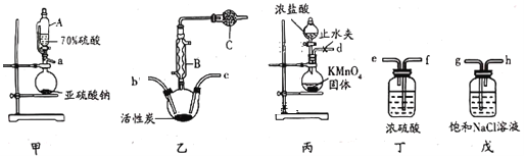
已知:①硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿的空气中“发烟”;
②SO2(g)+Cl2(g)=SO2Cl2(l),△H=-97.3kJ/mol。
(1)仪器A为恒压分液漏斗,与普通分液漏斗相比,其优点是___;仪器B的名称是___。
(2)上述装置的连接顺序:a接 , 接 , 接 , 接 , 接d。(装置可以重复使用)___
(3)球形干燥管C中的试剂为___,作用为___。
(4)硫酰氯在潮湿空气中“发烟”的原因是___(用化学方程式表示)
(5)在无活性炭存在的条件下SO2与Cl2也可发生反应,现将SO2、Cl2按照一定比例通入水中,请设计一个最简单的实验方案验证二者是否恰好完全反应:____。(简要描述实验操作,现象和结论)仪器自选,可供选择的试剂:酸性高锰酸钾溶液、碘化钾溶液、淀粉溶液、品红溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:H2SO4>![]() >H2CO3>
>H2CO3>![]() > HCO3—,综合考虑反应物的转化率和原料成本等因素,将
> HCO3—,综合考虑反应物的转化率和原料成本等因素,将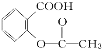 转变为
转变为![]() 的方法有
的方法有
A. 与足量的NaOH溶液共热后,再加入适量H2SO4
B. 与足量的NaOH溶液共热后,再通入足量CO2
C. 与稀H2SO4共热后,加入足量的NaHCO3溶液
D. 与稀H2SO4共热后,加入足量的Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~J均代表无机物或其水溶液,其中A是红色固体,H是生活中常见的液体,J是磁性材料,而B、D、G是单质,B是地壳中含量最高的金属元素,G是气体。根据图示回答问题:
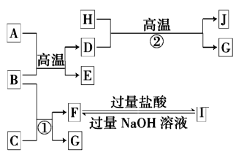
(1)写出下列物质的化学式:A_______,I___________。
(2)反应②的化学方程式是____________。
(3)上述物质D可与硫酸反应生成FeSO4,利用FeSO4可制得一种高效净水剂。方程式如下,若FeSO4和O2的化学计量数之比为2∶1,试配平下列方程式______:FeSO4+K2O2→K2FeO4+K2O+K2SO4+O2↑。
(4)高铁酸钾(K2FeO4)作为高效的绿色水处理剂,在水中发生反应生成Fe(OH)3,高铁酸钾作为水处理剂发挥的作用是____、____。
(5)氧化铁是重要工业颜料,用废铁屑制备氧化铁的流程如下:回答下列问题:
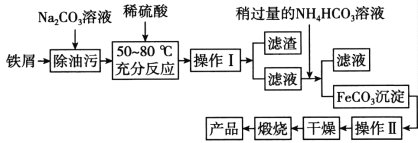
①操作I、Ⅱ的名称分别是_____、_________。
②加入NH4HCO3溶液后过滤,所得滤液的主要成份是:_________。
③写出在空气中锻烧FeCO3的化学方程式________;
(6)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定:a.称取2.850g绿矾 (FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为 20.00mL。计算上述样品中FeSO4·7H2O的质量分数为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com