
| A. | KOH | B. | LiCl | C. | H2 | D. | NH3 |
科目:高中化学 来源: 题型:选择题
| A. | v(W)=3v(Z) | B. | 2v(X)=3v(Z) | C. | 2v(X)=v(Y) | D. | 2v(W)=3v(X) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
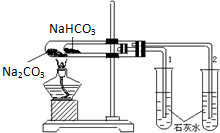 实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:
实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 正极 | Zn | Ag | C | Cu |
| 负极 | Cu | Cu | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
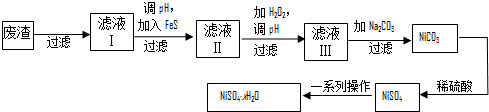
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2加入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑ | |
| B. | 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 向Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的CO2通入Na2SiO3溶液中 | |
| B. | 向AlCl3溶液中滴加稀氨水至过量 | |
| C. | 少量的CO2通入BaCl2溶液中 | |
| D. | 向FeCl3溶液中滴加NaOH溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

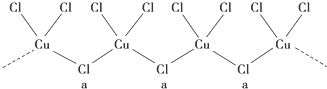
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com