
| A. | 1-己烯、苯 | B. | 乙烯、乙炔 | C. | 甲苯、苯 | D. | 己烷、戊烷 |
科目:高中化学 来源: 题型:选择题
| A. | H3PO2溶于水的电离方程式为:H3PO2?H++H2PO2- | |
| B. | H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-═PO23-+3H2O | |
| C. | 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物为H3PO4 | |
| D. | 用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-═O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
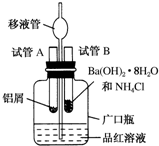 某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:
某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中金属与非金属的分界线附近可以找到半导体 | |
| B. | 周期表中F是最活泼的非金属,Li是最活泼的金属 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共18个纵行 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A组 | B组 | C组 | D组 |
| 金刚石:3 550℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1 410℃ | Na:98℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶体:2 300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1 723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知N2和H2在一定条件下发生下列可逆反应:
已知N2和H2在一定条件下发生下列可逆反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
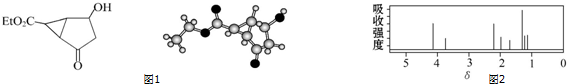
| A. | 该有机物不同化学环境的氢原子有6种 | |
| B. | 该有机物属于芳香化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能与金属钠、乙酸发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com