
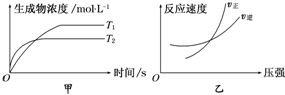
| A. | a+b>c+d T1>T2△H>0 | B. | a+b>c+d T1<T2 △H<0 | ||
| C. | a+b<c+d T1>T2△H>0 | D. | a+b>c+d T1>T2△H<0 |
分析 由甲图可知,T2先达到平衡,则T1<T2,且温度高时生成物浓度低,可知升高温度平衡逆向移动;
由乙图可知,在交叉点后正反应速率大于逆反应速率,可知增大压强平衡正向移动,以此来解答.
解答 解:由甲图可知,T2先达到平衡,则T1<T2,且温度高时生成物浓度低,可知升高温度平衡逆向移动,所以正反应为放热反应,即△H<0;
由乙图可知,在交叉点后正反应速率大于逆反应速率,可知增大压强平衡正向移动,该反应为气体体积减小的反应,即a+b>c+d,
故选B.
点评 本题考查化学平衡的影响因素,为高频考点,把握图中温度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意图象的分析与平衡移动的结合,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
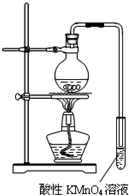 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
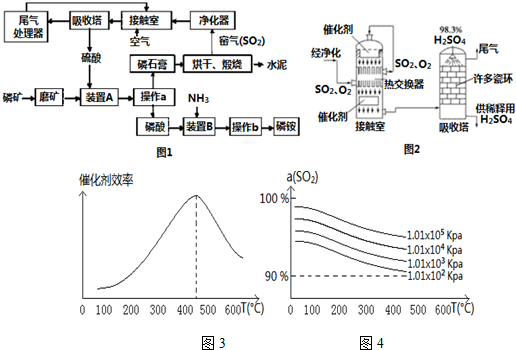
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com