
| A. | c(H+)=0.1mol/L的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ | |
| C. | c(Fe2+)=0.1mol/L的溶液:H+、Al3+、NO3-、SCN- | |
| D. | 在由水电离出的c(H+)=1×10-12mol/L的溶液:Fe3+、ClO-、Na+、SO42- |
分析 A.c(H+)=0.1mol/L的溶液,显酸性,离子之间发生氧化还原反应;
B.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液,溶液显碱性;
C.离子之间发生氧化还原反应;
D.由水电离出的c(H+)=1×10-12mol/L的溶液,为酸或碱溶液.
解答 解:A.c(H+)=0.1mol/L的溶液,显酸性,H+、S2O32-发生氧化还原反应,不能大量共存,故A错误;
B.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液,溶液显碱性,该组离子之间不反应,可大量共存,故B正确;
C.H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故C错误;
D.由水电离出的c(H+)=1×10-12mol/L的溶液,为酸或碱溶液,碱性溶液中不能大量存在Fe3+,酸溶液中不能大量存在ClO-,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ | |
| D. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 普通玻璃和钢化玻璃的成分不一样,钢化玻璃中加了玻璃钢 | |
| B. | 水泥的主要成分是硅酸二钙、硅酸三钙和铝酸三钙 | |
| C. | 水泥具有水硬性,因此在保存和运输过程中要注意防水防潮 | |
| D. | 陶瓷的釉料在烧制时,若空气过量,一般显示的是高价态的金属的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2与盐酸 Cu(OH)2与醋酸 | |
| B. | BaCl2溶液与Na2SO4溶液 Ba(OH)2溶液与Na2SO4溶液 | |
| C. | NaHCO3溶液与NaHSO4溶液 Na2CO3溶液与NaHSO4溶液 | |
| D. | 石灰石与硝酸 生石灰与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| B. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 | |
| C. | 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化 | |
| D. | 合金超导材料是指熔合两种或两种以上的金属元素并形成具有超导电性的超导材料,如铌一钛(Nb-Ti)合金,它的熔点一般比纯钛要低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
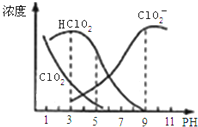 亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )| A. | 亚氯酸钠在酸性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数值Ka=10-6 | |
| C. | pH越大,该漂白剂的漂白性能越好 | |
| D. | 25℃,pH=3时,NaClO2溶液中:c(Na+)+c(H+)=c(ClO2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
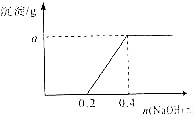 用3.2g含有一定杂质的镁条与足量的稀硫酸反应制取氢气(杂质不与硫酸反应),收集到氢气2.24L(已折算到标准状况下),再往反应后的溶液中滴加NaOH溶液,使镁元素转化成Mg(OH)2沉淀,发现生成的沉淀质量与加入NaOH溶液中NaOH的物质的量有如图所示关系,试求:
用3.2g含有一定杂质的镁条与足量的稀硫酸反应制取氢气(杂质不与硫酸反应),收集到氢气2.24L(已折算到标准状况下),再往反应后的溶液中滴加NaOH溶液,使镁元素转化成Mg(OH)2沉淀,发现生成的沉淀质量与加入NaOH溶液中NaOH的物质的量有如图所示关系,试求:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com